
题目列表(包括答案和解析)

| ||
| ||
| ||
| ||
| ||
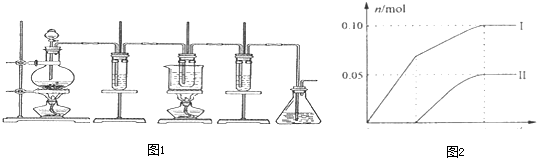
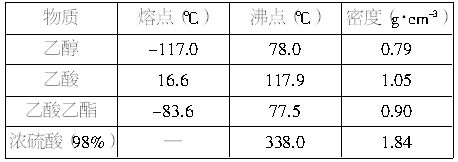
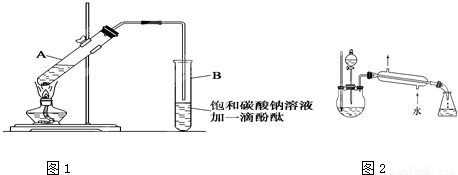
 中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液。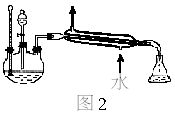
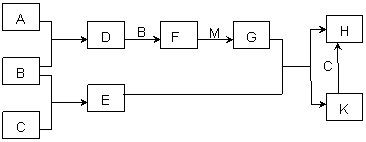
已知:A、B、C为中学常见的单质,A为淡黄色固体;D、E、F为中学常见
的氧化物,E是具有磁性的黑色晶体;H、K为中学常见的盐;M为一种常见的无色液
体。各物质间的转化关系如下图所示(某些条件已略去)。
 |
请回答:
(1)物质K的化学式为 。
(2)物质M的电子式为 。
(3)D可使酸性KMnO4溶液褪色,体现了D物质的 (填字母序号)。
A. 氧化性 B. 还原性 C. 漂白性
(4)C与M在一定条件下反应的化学方程式为 。
(5)先将D气体通入BaCl2溶液中,再通入NH3,实验过程中的现象为
。
(6)H溶液在空气中常期放置会出现红褐色浑浊,请用一个离子方程式表示其变化的原因: 。
(7)A与C可以在一定条件下发生化合反应,其产物中元素A与C的质量比为4:7,该物质是某矿石的主要成分之一,常用于生产G。某化工厂所用矿石样品含杂质25%,若取8.8吨该矿石,假设生产过程中无其他损失,可制得含G 98%的产品 吨。
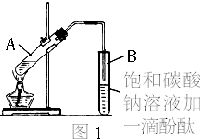
| 物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com