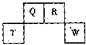
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的离子结构示意图为
.
(2)元素的非金属性为(原子的得电子能力):Q
弱于
弱于
W(填“强于”或“弱于”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
.
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
.
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
NaNO2
NaNO2
I、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子核外电子排布式是
1s22s22p63s23p3
1s22s22p63s23p3
.
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca
3(PO
4)
2+6SiO
2→6CaSiO
3+P
4O
10 10C+P
4O
10→P
4+10CO
每生成1mol P
4时,就有
20
20
mol电子发生转移.
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(1)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl
3易发生水解,无水CeCl
3可用加热CeCl
3?6H
2O和NH
4Cl固体混合物的方法来制备.其中NH
4Cl的作用是
分解出HCl气体,抑制CeCl3的水解
分解出HCl气体,抑制CeCl3的水解
.
(2)在某强酸性混合稀土溶液中加入H
2O
2,调节pH≈3,Ce
3+通过下列反应形成Ce(OH)
4沉淀得以分离.完成反应的离子方程式:
2
2
Ce
3++
1
1
H
2O
2+
6
6
H
2O→
2
2
Ce(OH)
4↓+
6H+
6H+
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.
反应物A的浓度随时间的变化如图所示.
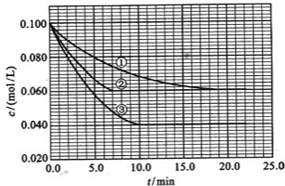
请回答下列问题:
(3)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:②
加催化剂
加催化剂
;
达到平衡的时间缩短,平衡时A的浓度未变
达到平衡的时间缩短,平衡时A的浓度未变
.
③
温度升高
温度升高
;
达到平衡的时间缩短,平衡时A的浓度减小
达到平衡的时间缩短,平衡时A的浓度减小
.
(4)实验②平衡时B的转化率为
40%
40%
;实验③平衡时C的浓度为
0.06mol/L
0.06mol/L
;
(5)该反应是
吸热
吸热
热反应,判断其理由是
温度升高,平衡向正反应方向移动
温度升高,平衡向正反应方向移动
;
(6)该反应进行到4.0min时的平均反应速度率:
实验②:V
B=
0.014mol(L?min)-1
0.014mol(L?min)-1
.




 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

