
题目列表(包括答案和解析)
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)近年来,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断:
当事人使用的液态洁污剂之一必定含氯,最可能的存在形式是 和 。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气:
。
(2)次氯酸盐的氧化性较强,可在碱性环境中将许多物质氧化,例如可用其将Fe3+氧化为新型杀菌消毒剂FeO42-,写出该反应的离子方程式 。
(3)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:
W(s)+I2(g)![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。ks*5*u
|
|
|
|

则:①该反应的△H 0(填“>” 或“=”或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(4)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液后,溶液中离子浓度由大到小的顺序是 。
[不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(5)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl2(g)=MgCl2(s) △H= —641kJ/mol ②Ti(s)+2Cl2(g)=TiCl4(l) △H= —770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)近年来,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。根据你的化学知识作出如下判断:
当事人使用的液态洁污剂之一必定含氯,最可能的存在形式是 和 。当另一种具有 (性质)的液态洁污剂与之混合,可能发生如下反应而产生氯气:
。
(2)次氯酸盐的氧化性较强,可在碱性环境中将许多物质氧化,例如可用其将Fe3+氧化为新型杀菌消毒剂FeO42-,写出该反应的离子方程式 。
(3)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:
W(s)+I2(g)![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中, 加热使其反应。
如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。
|
|
|
|
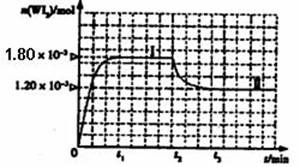
则:①该反应的△H 0(填“>” 或“=”或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(4)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液后,溶液中离子浓度由大到小的顺序是 。
[不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(5)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl2(g)=MgCl2(s) △H= —641kJ/mol ②Ti(s)+2Cl2(g)=TiCl4(l) △H= —770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
| 实验步骤 | 实验现象 |
| ①将一小块金属钠投入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过)分别投入足量的相同体积0.5mol?L-1盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol?L-1盐酸和3mol?L-1盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子各不相同,分别含有五种阳离子(Na+、Al3+、Mg2+、Ba2+、Fe3+)和五种阴离子(Cl-、OH-、NO3-、CO32-、X)中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是______________和______________(均填化学式)。
(2)为了确定X,现将 (1) 中的两种物质记为A、B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生沉淀。向该沉淀中滴入过量稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解。则:
①X为___________(填序号)。
A.SO32- B.SO42- C.CH3COO- D.SiO32-
②A中的化学键类型为______________。
③B的水溶液中所有离子的浓度由大到小的顺序为:_____________________________(用离子符号表示)。
④C与B混合时,对应的方程式为_____________________________________________。
(3)将Cu投入D溶液中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的______________(填相应的离子符号)。
(4)利用上述已经确定的物质,再做一个实验就可以确定D、E,该实验可以是_________。
A.向D、E中分别加入足量的NaOH B.向D、E中分别加入AgNO3溶液
C.观察溶液的颜色 D.分别测D、E溶液导电能力
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子各不相同,分别含有五种阳离子(Na+、Al3+、Mg2+、Ba2+、Fe3+)和五种阴离子(Cl-、OH-、NO3-、CO32-、X)中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是______________和______________(均填化学式)。
(2)为了确定X,现将 (1) 中的两种物质记为A、B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生沉淀。向该沉淀中滴入过量稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解。则:
①X为___________(填序号)。
A.SO32- B.SO42- C.CH3COO- D.SiO32-
②A中的化学键类型为______________。
③B的水溶液中所有离子的浓度由大到小的顺序为:_____________________________(用离子符号表示)。
④C与B混合时,对应的方程式为_____________________________________________。
(3)将Cu投入D溶液中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的______________(填相应的离子符号)。
(4)利用上述已经确定的物质,再做一个实验就可以确定D、E,该实验可以是_________。
A.向D、E中分别加入足量的NaOH B.向D、E中分别加入AgNO3溶液
C.观察溶液的颜色 D.分别测D、E溶液导电能力
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com