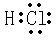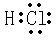中学化学常见的物质A、B、C、D之间存在如下转化关系:A+B→C+D+H
2O(没有配平).请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体.C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是:
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
,鉴别这两种气体不能选用的试剂是
a
a
a.BaCl
2溶液 b.KMnO
4溶液 c.品红溶液 d.酸化的Ba(NO
3)
2溶液
向500mL2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的化学方程式是
5NaOH+4CO2═Na2CO3+3NaHCO3+H2O
5NaOH+4CO2═Na2CO3+3NaHCO3+H2O
.此时溶液中的离子按照浓度由大到小排列的顺序是
c(Na+)>c(HCO3-)>c(CO3 2- )>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO3 2- )>c(OH-)>c(H+)
.
(2)若A为红色金属单质,与适量B的溶液在常温下恰好完全反应,生成的无色气体C遇空气迅速变成经棕色.若被还原的B物质的量为2mol时,产生C气体的体积是
44.8
44.8
L(标况).将生成的红棕色气体通入一个烧瓶里,塞紧瓶塞后,将烧瓶浸入冰水中,烧瓶中气体的颜色变浅,请用化学方程式和必要的文字解释颜色变化的原因
2NO2(红棕色)?N2O4(无色);△H<0,降温,平衡向正反应方向移动,红棕色NO2浓度减小,混合气体的颜色变浅
2NO2(红棕色)?N2O4(无色);△H<0,降温,平衡向正反应方向移动,红棕色NO2浓度减小,混合气体的颜色变浅
.
(3)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一.C发生水解反应的离子方程式是
ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
(4)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体.检验A中阴离子的方法是
取少量A于一洁净试管中,加蒸馏水溶解后,滴加硝酸银溶液,产生白色没淀,再滴加稀硝酸,振荡,沉淀不溶解,则A的阴离子为Cl-
取少量A于一洁净试管中,加蒸馏水溶解后,滴加硝酸银溶液,产生白色没淀,再滴加稀硝酸,振荡,沉淀不溶解,则A的阴离子为Cl-
(简述操作过程及结论).