
题目列表(包括答案和解析)
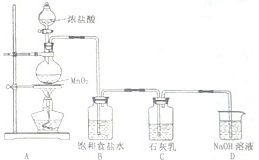 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
| ||
| ||
| ||
| ||
下列有关实验操作中,正确的是
A.用试管取出试剂瓶中的NaOH溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B.银镜反应实验后的废液可先倒入水槽中,再用水冲入下水道
C.向试管中滴加液体时,胶头滴管必须紧贴试管内壁,避免液体溅出
D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
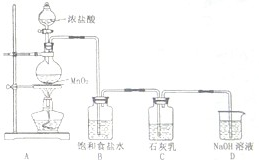
 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com