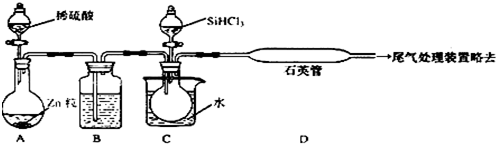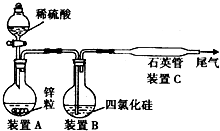
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅:SiO
2+2C
Si+2CO↑.
②粗硅与干燥的Cl
2反应制得SiCl
4:Si+2C1
2SiCl
4.
③SiCl
4被过量的H
2在1 000~1 100℃时还原制得纯硅:SiCl
4+2H
2Si+4HCl.
某同学从资料中查知:SiCl
4的熔点为-7O℃,沸点为57.6℃,且在潮湿的空气中能发生水解反应.该同学设计了如下制取纯硅的实验装置(热源及夹持装置已略去).请回答下列问题:
(1)使SiCl
4从装置B中逸出与H
2充分混合,应采取的措施是
对装置B水浴加热
对装置B水浴加热
.
(2)装置C不能采用普通玻璃管的原因是
在1000-1100℃时普通玻璃管会软化
在1000-1100℃时普通玻璃管会软化
,石英的化学式是
SiO2
SiO2
.
(3)如果从装置A中快速向装置B中通入气体,可能观察到的现象是
B中液面上方产生少量白雾,液体中有少量白色胶状物生成
B中液面上方产生少量白雾,液体中有少量白色胶状物生成
.
(4)为防止空气污染,含有SiCl
4的尾气要通入盛有
NaOH
NaOH
溶液的烧杯中,反应的化学方程式为
SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O
SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O
.
(5)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度,还应对该装置进行的改进是
在装置A与B之间连接一盛有浓硫酸的洗气瓶(或盛有碱石灰的干燥管).
在装置A与B之间连接一盛有浓硫酸的洗气瓶(或盛有碱石灰的干燥管).
.

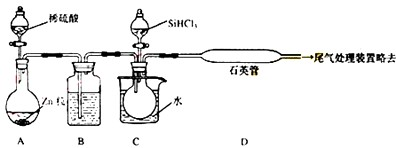
 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下: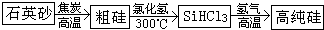
 甲、乙、丙、丁均具有如图所示的结构或结构单元.实线表示共价键,X、Y可同可不同.
甲、乙、丙、丁均具有如图所示的结构或结构单元.实线表示共价键,X、Y可同可不同.