
题目列表(包括答案和解析)

| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
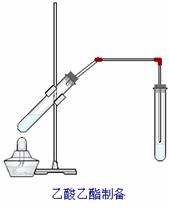 如右图所示,在大试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。在小试管中加入5 mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对大试管小火加热3~5 min后,改用大火加热,当观察到小试管中有明显现象时停止实验。 (1)写出大试管中主要反应的化学方程式: ; (2)加入浓硫酸的作用是:___________________;
如右图所示,在大试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。在小试管中加入5 mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对大试管小火加热3~5 min后,改用大火加热,当观察到小试管中有明显现象时停止实验。 (1)写出大试管中主要反应的化学方程式: ; (2)加入浓硫酸的作用是:___________________;
(3)饱和Na2CO3的作用是:_______________ _________;
(4)反应开始时用酒精灯对大试管小火加热的原因是: ;(已知乙酸乙酯的沸点为77 ℃;乙醇的沸点为78.5 ℃;乙酸的沸点为117.9 ℃)后改用大火加热的目的是: 。
(5)分离小试管中所得乙酸乙酯和Na2CO3溶液的操作为(只填名称) ,所需主要仪器有 。
(6)实验生成乙酸乙酯,其密度比水 ,有 气味。
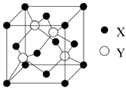 (2013?江苏)A.[物质结构与性质]
(2013?江苏)A.[物质结构与性质]
| 成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com