
题目列表(包括答案和解析)

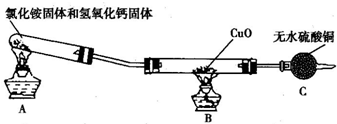
某学生为测定氯化铵与硫酸铵混合物中氯化铵的质量分数,按下图所示的实验步骤进行实验:

请回答下列问题:
(1)A的分子式是________,物质C分子式为________.
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码16g,游码为0.4g,则右盘样品的实际质量是________g.
(3)若过滤用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要的仪器或用品是________.
(4)证明A溶液滴加适量的操作方法是________________.
(5)若物质C的质量为23.3g,则原混合物中NH4Cl的质量分数NH4Cl%=________.
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液体积/mL | 40.00mL | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com