
题目列表(包括答案和解析)
某学生设计一个实验证明PbO中含有氧元素,反应式如下:
PbO+C ![]() Pb+CO↑,
Pb+CO↑,
PbO+CO![]() Pb+CO2
Pb+CO2
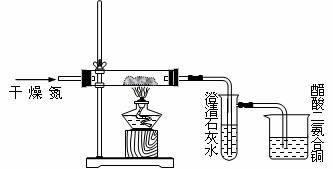
回答下列问题:
(1)此装置图中有个明显的错误,请指出。
(2)盛澄清石灰水的试管开始一段时间可能没有现象,请指出可能的原因
(3)烧杯中醋酸二氨合铜的作用是什么?
(4)若用空气代替干燥的氮气,行吗?为什么?
| Fe2O3 | CO | Fe | CO2 | |
| 甲 | 1.0mol | 1.0mol | 1.0mol | 1.0mol |
| 乙 | 1.0mol | 2.0mol | 1.0mol | 1.0mol |
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品于烧杯中加适量稀硫酸溶解 | \ |
| 步骤2: 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 |
若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 |
| 步骤3: 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 |
若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 |
| 步骤4: 空 空 |
空 空 |
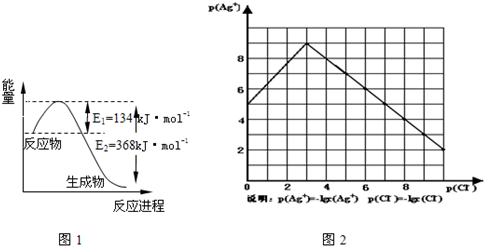
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
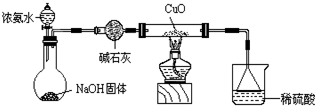 (2012?揭阳一模)某校研究性学习小组探究Cu的常见化合物性质,过程如下:
(2012?揭阳一模)某校研究性学习小组探究Cu的常见化合物性质,过程如下: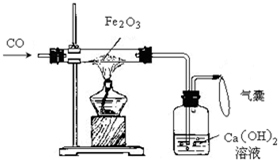
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com