
题目列表(包括答案和解析)
《物质结构与性质》模块选择题
1.下列性质不能用金属键理论解释的是
A.导电性 B.导热性 C.延展性 D.锈蚀性
2.下列说法错误的是
A.O3与SO2的结构与性质相似
B.硫粉不溶于水,易溶于CS2中
C.Be(OH)2是两性氢氧化物
D.在相同条件下,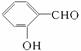 的沸点高于
的沸点高于![]()
3.氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,根据氨水的性质可推知NH3·H2O的结构式为
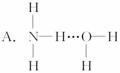


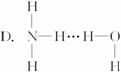
《有机化学基础》模块选择题
4.已知某有机物A的分子式C2H6O的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
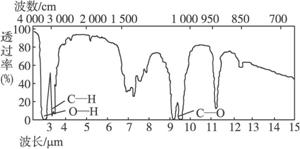
未知物A的红外光谱
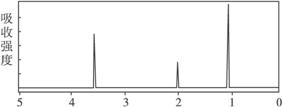
未知物A的核磁共振氢谱
A.由红外光谱可知,该有机物中至少含有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为1∶2∶3
C.仅由其核磁共振氢谱可知其分子中的各类型氢原子总数
D.则A的结构简式为CH3—O—CH3
5.在阿司匹林的结构简式(下式)中①②③④⑤⑥分别标出了其分子中的不同的键。将阿司匹林与足量NaOH溶液共煮时,发生反应时断键的位置是
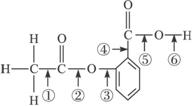
A.①④ B.②⑤ C.③④ D.②⑥
6.举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如下式,下列有关该物质的说法正确的是
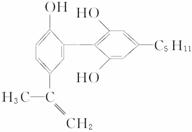
A.该分子中所有碳原子可以稳定地共存在一个平面中
B.1 mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4 mol、7 mol
C.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
D.滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键



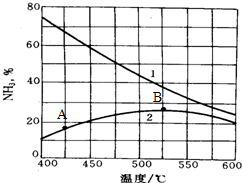
(I)多项选择题(6分)
化学与科学、技术、社会、环境密切相关,下列做法中正确的是__________。
A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放
B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
C.为了有效的发展清洁能源,采用电解水的方法大量制备H2
D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体
E.利用化学反应原理,设计和制造新的药物
(II)(14分)
浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,下图是海水加工的示意图,根据下图回答问题。
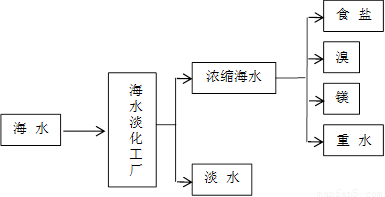
(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。

(3)制备金属镁是通过电解熔融的MgC12,而不用MgO,其原因是 。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是 。
(5)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:3
SiCl4(g)+2 H2(g)+Si(g)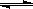 4
SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为
kg。
4
SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为
kg。
(I)多项选择题(6分)
化学与科学、技术、社会、环境密切相关,下列做法中正确的是__________。
| A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放 |
| B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
C.为了有效的发展清洁能源,采用电解水的方法大 量制备H2 量制备H2 |
| D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
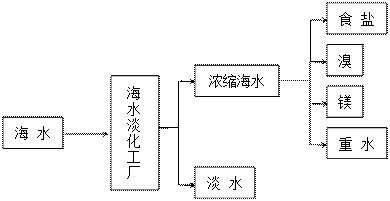
 的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。
的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。
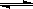 4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的
4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的 质量为 kg。
质量为 kg。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com