
题目列表(包括答案和解析)
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2+H2(g)
CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2):
|
反应时间/min |
n(CO)/mol |
H2O/ mol |
|
0 |
1.20 |
0.60 |
|
t1 |
0.80 |
|
|
t2 |
|
0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为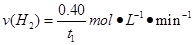
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
非选择题
非选择题 【共道小题,分】【14分】下图是实验室验证某铜银合金完全溶解于一定量的浓硝酸时,生成NO2气体中含有NO的实验装置。常温下,NO2与N2O4混合存在,在低于0 ℃时,几乎只有白色N2O4晶体存在。
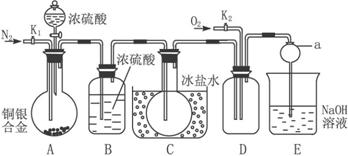
(1)反应前打开A部分的活塞K1,持续通一段时间氮气,其理由是_____________________
_____________________________________________________________________。
(2)若装置中缺B部分,其后果是__________________________________________________。
(3)反应结束后,打开D部分的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热的氧气,则瓶内气体的颜色比前者更深,其原因是__________________________。
(4)E部分中a仪器所起的作用是______________________________________________。
(5)已知该铜银合金的质量为15 g,加入40 mL 135 mol·L-1的浓硝酸,实验结束后,A部分烧瓶内溶液中的c(H+)=1 mol·L-1(假设反应中HNO3既无挥发也无分解,体积仍为40 mL)。
①参加反应硝酸的物质的量为_____________________。
②为测定铜银合金中铜的质量分数,还需要进行的主要实验操作是_____________________。
下表是元素周期表的一部分。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | | | | | | |
| 二 | ② | ③ | ④ | | ⑤ | ⑥ | |
| 三 | | ⑦ | ⑧ | | | ⑨[ | ⑩ |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | H2O/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 |
|
| t2 |
| 0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为![]()
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
非选择题
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么![]() (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量![]() m(H20),由此计算
m(H20),由此计算![]() 。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
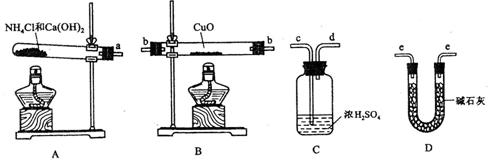
请回答下列问题:[来源:学§科§网Z§X§X§K]
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大![]() 的是_______________ (填序号);
的是_______________ (填序号);
![]() Cu0未完全起反应 ② CuO不
Cu0未完全起反应 ② CuO不![]() 干燥
干燥
![]() Cu0中混有不反应的杂质 ④ 碱石灰不干燥
Cu0中混有不反应的杂质 ④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或__________![]() _____和_______________达到实验目的。
_____和_______________达到实验目的。
选考题(请考生在第18、19、20三题中任选一题做答,如果多做,则按所做的第一题计分。做答时用2B铅笔在答题卡上把所选题目的题号涂黑)。
第18、19、20三题的第Ⅰ题为选择题,在给出的四个选项中,至少有两项是符合
题目要求的,请将符合题目要求的选项标号填在答题卡相应位置;第Ⅱ题为非选择题,
请在答题卡相应位置做答并写明小题号。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com