
题目列表(包括答案和解析)
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.50 | 2.25 |
| 900 | 2.50 | 1.50 |
| c(CO) |
| c(H2) |
以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:

(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在______的郊区(填标号)
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)沸腾炉中发生反应的化学方程式为_____,接触室中发生反应的化学方程式是_____。
(3) 在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是_____。
A. 硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B. 从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C. SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D. SO3用98. 3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提髙SO3吸收效率
(4) 下表是压强对SO2平衡转化率的影响

对于SO2转化SO3的反应,增大压强可使转化率______________,但在实际工业生产中常采用常压条件,理由是________________________________。
(5)某工厂用500t含硫量为48%的黄铁矿制备硫酸,若在沸腾炉中有2%的FeS2损失,在接触室中SO3的产率为96%,则可得到98%的浓硫酸的质量是_____t。
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.50 | 2.25 |
| 900 | 2.50 | 1.50 |
| c(CO) |
| c(H2) |
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.50 | 2.25 |
| 900 | 2.50 | 1.50 |
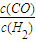 的值最大.
的值最大. 2C (均为无色)______________
2C (均为无色)______________ 2XY 其中Y2是有色物质_____________
2XY 其中Y2是有色物质_____________湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com