黄铁矿(主要成分为FeS
2)是我国大多数硫酸厂制取硫酸的主要原料.某化学学习小组对某黄铁矿石进行如下实验探究.
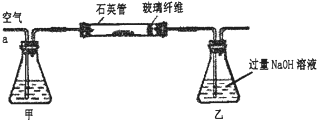
[实验一]测定硫元素的含量.
Ⅰ、将m
1g该黄铁矿样品放入如右图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中发生反应的化学方程式为:4FeS
2+11O
2═2Fe
2O
3+8SO
2Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:
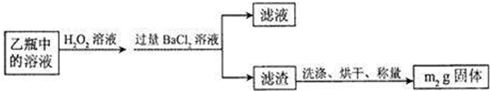
[实验二]测定铁元素的含量.
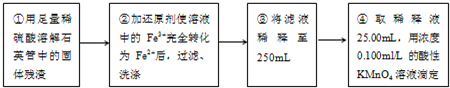
III、测定铁元素含量的实验步骤如图所示.
问题讨论:
(1)I中,甲瓶内所盛试剂是
NaOH
NaOH
溶液.乙瓶内发生反应的离子方程式为
SO2+2OH-=SO32-+H2O、2SO32-+O2=2SO42-
SO2+2OH-=SO32-+H2O、2SO32-+O2=2SO42-
.
(2)II中,乙瓶加入H
2O
2溶液时反应的离子方程式为
SO32-+H2O2═SO42-+H2O
SO32-+H2O2═SO42-+H2O
.
(3)该黄铁矿中硫元素的质量分数为
.
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有
250ml容量瓶
250ml容量瓶
.
(5)III的步骤④中,表示滴定已达终点的现象是
最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色
最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色
.
(6)Ⅲ的步骤④进行了三次平行实验,测得消耗KMnO
4溶液体积分别为24.98mL、24.80mL、25.02mL(KMnO
4被还原为Mn
2+).根据上述数据,可计算出该黄铁矿样品铁元素的质量分数为
.



