
题目列表(包括答案和解析)
 2Fe2+(aq)+I2(aq)反应的平衡常数表达式为Kc= ________ .当上述反应达到平衡后,加入CCl4萃取I2且温度不变,上述平衡向_________ (填“向左”“向右”或“不变”)移动。
2Fe2+(aq)+I2(aq)反应的平衡常数表达式为Kc= ________ .当上述反应达到平衡后,加入CCl4萃取I2且温度不变,上述平衡向_________ (填“向左”“向右”或“不变”)移动。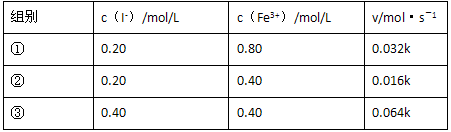
 2Fe2+ +I2(水溶液中)。
2Fe2+ +I2(水溶液中)。 
Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+![]() 2Fe2++I2(水溶液)
2Fe2++I2(水溶液)
(1)该反应的平衡常数K的表达式为:K=________.
当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡________移动(选填“向右”“向左”“不”).
(2)上述反应的正向反应速率和I-,Fe3+的浓度关系为:v=K[c(I-)]m[c(Fe3+]n(K为常数)

通过所给的数据计算得知:
在v=K[c(I-)]m[c(Fe3+]n中,m,n的值为________
I-浓度对反应速率的影响________Fe3+浓度对反应速率的影响.(选填“大于”“小于”“等于”)
Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+![]() 2Fe2++I2(水溶液)
2Fe2++I2(水溶液)
(1)该反应的平衡常数K的表达式为:K=________.
当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡________移动(选填:向右、向左、不).
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为v=K[C(I-)]m[C(Fe3+)]n(K为常数)

通过所给的数据计算得知:
在v=K[C(I-)]m[C(Fe3+)]n中,m、n的值为
[ ]
I-浓度对反应速率的影响________Fe3+浓度对反应速率的影响.(选填小于、大于、等于)
(每空2分,共22分)
I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L · s)]与反应时间t(s)的关系如图所示。回答如下问题:
(1)该反应的化学方程式:
(2)0→t2时间段内反应速率增大的原因是: ,
(3)t2→t时间段内反应速率减小的原因是: ,
(4)图中阴影部分“面积”表示t1→t3时间里 。
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
II. 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如上图甲可观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如上图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是
(3)加入0.01mol MnO2粉末于60mL H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示。设放出气体的总体积为V mL。
①放出V/3 mL气体时所需时间为 min。
② 该H2O2溶液的浓度为
③A、B、C、D各点反应速率快慢的顺序为 > > >
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com