
题目列表(包括答案和解析)
工业制碱纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3 ①
NH4HCO3+NaCl(饱和)=HaHCO3↓+NH4Cl ②
将所得碳酸氢钠晶体加热分解后即可得到纯碱.
请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因是________.
(2)现有甲、乙、丙三个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下.
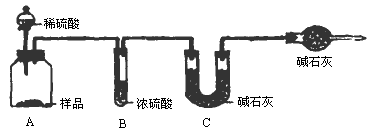
甲组:取10.00g样品,利用上图所示装置,测出反应后装置C中碱石灰的增重为3.52g.
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2NaCl+2H2O+CO2↑).完成三次平行实验后,消耗盐酸体积的平均值为30.00mL.
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g.请分析、计算后填表:

| |||||||||||
氨气是化学工业上应用非常广泛的物质。下面仅是它在两方面的重要用途。
“侯氏制碱法”的发明为振兴中国化工工业做出了重要贡献。制碱法的第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为:NaCl + CO2 + NH3 + H2O → NaHCO3↓+ NH4Cl
现在45℃时,取117g食盐配制成饱和溶液,向其中通入适量氨气后,再向其中通入二氧化碳,使反应进行完全。试计算并回答下列问题(计算结果取三位有效数字)(有关物质的溶解度数据如表,单位:g/100g水)。
|
|
NaCl |
NaHCO3 |
NH4Cl |
|
10℃ |
35.8 |
8.15 |
33.0 |
|
45℃ |
37.0 |
14.0 |
50.0 |
(1)117g食盐理论上可以制取纯碱 g;
(2)45℃反应完毕后,有晶体析出;溶液中剩余水 g,析出晶体的质量 g。
(3)过滤除去析出的晶体后再降温至10℃,又有晶体析出,计算所析出晶体的质量共 克
工业制硝酸也是氨气重要用途之一,反应如下:
4NH3+5O2→4NO+6H2O 2NO+O2→2NO2 3NO2+H2O→2HNO3+NO
将a mol的NH3与b mol的O2混合后,充入一密闭容器,在Pt存在下升温至700℃,充分反应后,冷却至室温。
 (4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
(4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
|
b∕a的取值范围 |
溶质 |
溶质物质的量 |
|
|
|
|
|
|
—— |
—— |
|
|
|
|
|
|
|
|
氨气是化学工业上应用非常广泛的物质。下面仅是它在两方面的重要用途。
“侯氏制碱法”的发明为振兴中国化工工业做出了重要贡献。制碱法的第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为:NaCl + CO2 + NH3 + H2O → NaHCO3↓+ NH4Cl
现在45℃时,取117g食盐配制成饱和溶液,向其中通入适量氨气后,再向其中通入二氧化碳,使反应进行完全。试计算并回答下列问题(计算结果取三位有效数字)(有关物质的溶解度数据如表,单位:g/100g水)。
| | NaCl | NaHCO3 | NH4Cl |
| 10℃ | 35.8 | 8.15 | 33.0 |
| 45℃ | 37.0 | 14.0 | 50.0 |
 (4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
(4)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:| b∕a的取值范围 | 溶质 | 溶质物质的量 |
| | | |
 | —— | —— |
| | | |
| | | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com