
题目列表(包括答案和解析)
实验室用粗锌与稀硫酸反应制取氢气,利用氢气还原氧化铜来测定铜的相对原子质量。实验装置如下:

(1)在启普发生器中纯锌与稀硫酸反应过于缓慢,可采取的加快速率的措施是①适当增大硫酸的浓度,②_______________________。
(2)用纯度不高的锌(粗锌)制取氢气,反应速率快,但制得的氢气因含H2S等还原性杂质而有难闻的气味,CuSO4洗气瓶中观察到的现象是_______________,是否可以将CuSO4溶液换成浓硫酸_________(答“是”或“否”) ;理由是__________________________。
(3)有同学发现粗锌与稀硫酸反应一段时间后,锌粒表面变黑,于是收集了少量该黑色固体,验证黑色固体含铁元素的简单化学方法_________________________________________。
(4)实验中得到的数据有:小瓷皿的质量m g,小瓷皿加样品的质量n g,反应后小瓷皿加固体的质量w g,已知氧的相对原子质量为16,则铜的相对原子质量是____________(用含m、n、w的代数式表示)。
(5)某次实验中测定结果明显偏大,可能的原因是________(选填编号)。
a.未充分冷却即停止通氢气 b.氧化铜样品中含有氯化铵杂质
c.反应后固体中有少量Cu2O d.氢气不干燥有少量水分
(6)由于启普发生器药品用量较多,利用下列仪器装配一套有启普发生器功能的简易装置,你选择____________(选填编号) (支撑仪器、橡皮塞、导气管略)。

(a) (b) (c) (d) (e) (f)
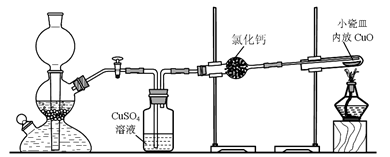
实验室用粗锌与稀硫酸反应制取氢气,利用氢气还原氧化铜来测定铜的相对原子质量。实验装置如下: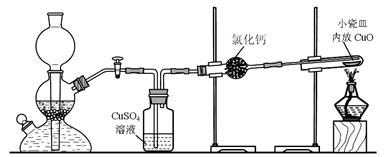
(1)在启普发生器中纯锌与稀硫酸反应过于缓慢,可采取的加快速率的措施是①适当增大硫酸的浓度,②_______________________。
(2)用纯度不高的锌(粗锌)制取氢气,反应速率快,但制得的氢气因含H2S等还原性杂质而有难闻的气味,CuSO4洗气瓶中观察到的现象是_______________,是否可以将CuSO4溶液换成浓硫酸_________(答“是”或“否”) ;理由是__________________________。
(3)有同学发现粗锌与稀硫酸反应一段时间后,锌粒表面变黑,于是收集了少量该黑色固体,验证黑色固体含铁元素的简单化学方法_________________________________________。
(4)实验中得到的数据有:小瓷皿的质量mg,小瓷皿加样品的质量n g,反应后小瓷皿加固体的质量w g,已知氧的相对原子质量为16,则铜的相对原子质量是____________(用含m、n、w的代数式表示)。
(5)某次实验中测定结果明显偏大,可能的原因是________(选填编号)。
a.未充分冷却即停止通氢气 b.氧化铜样品中含有氯化铵杂质
c.反应后固体中有少量Cu2O d.氢气不干燥有少量水分
(6)由于启普发生器药品用量较多,利用下列仪器装配一套有启普发生器功能的简易装置,你选择____________(选填编号) (支撑仪器、橡皮塞、导气管略)。
(a) (b) (c) (d) (e) (f)

(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片上____________(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图A),组成一个原电池,负极为___________,正极的电极反应式为___________.
(2)如果烧杯中最初装入的是2mol/L500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)___________.
(3)金属的腐蚀分为两种:化学腐蚀(与化学物质直接接触而发生化学反应)和电化学腐蚀(由于构成原电池而发生电极反应),电化学腐蚀中又分为吸氧腐蚀和析氢腐蚀.如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,主要发生___________电化学腐蚀,写出正极的电极反应式一.

(4)生活中利用原电池原理生产了各种各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其最主要原因是___________.
(A)回收利用电池外壳的金属
(B)防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
(C)防止电池中渗泄的电解液腐蚀其他物品
(D)回收其中的石墨电极
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片上____________(填“有”或“没有”)气泡产生.再用导线把锌片和铜片连接起来(见图A),组成一个原电池,负极为___________,正极的电极反应式为___________.
(2)如果烧杯中最初装入的是2mol/L500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)___________.
(3)金属的腐蚀分为两种:化学腐蚀(与化学物质直接接触而发生化学反应)和电化学腐蚀(由于构成原电池而发生电极反应),电化学腐蚀中又分为吸氧腐蚀和析氢腐蚀.如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,主要发生___________电化学腐蚀,写出正极的电极反应式一.

(4)生活中利用原电池原理生产了各种各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其最主要原因是___________.
(A)回收利用电池外壳的金属
(B)防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
(C)防止电池中渗泄的电解液腐蚀其他物品
(D)回收其中的石墨电极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com