
题目列表(包括答案和解析)
(8分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1)定性分析:如图甲可通过观察___________________________________定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式:
_____________________________________________________。
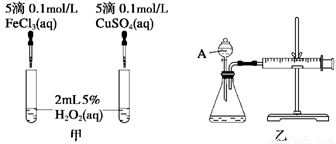
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是_________________。
(共14分)为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
① 甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液 C.浓氨水 D.酸性KMnO4溶液
② 乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O===2HBr +H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 。
[探究二]
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。

(3)装置B中试剂的作用是
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 (选填序号)。
A.A之前 B.A-B间 C.B-C间 D.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是
(8分) 为提高人体素质, 避免人体缺碘影响正常的生命活动,我国早已采取食盐加碘措施。据报道, 人从食物中摄取碘后碘便在甲状腺中积存下来, 通过一系列化学反应可形成甲状腺素。甲状腺素的结构如下图,回答下列问题:
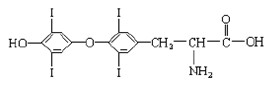
(1)甲状腺素由________种元素组成;
(2)“加碘食盐”中的碘元素以碘酸钾(KIO3 )的形式存在 , KIO3中碘的化合价是 ,我们用稀盐酸和淀粉KI试纸可以检验食盐中碘酸钾的存在,实验现象是 。
(3)在“加碘食盐”包装袋上有“烹调时,待食品熟后加入碘盐” 文字说明,由此可推测碘酸钾在受热时容易 。
(共14分)为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液 C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O===2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 。
[探究二]
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
(3)装置B中试剂的作用是
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 (选填序号)。
A.A之前 B.A-B间 C.B-C间 D.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是
(14分)为研究盛装浓硫酸的铁质材料(碳素钢)与浓硫酸的反应,某学习小组进行了以下探究活动:
[实验]取一铁钉放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为x中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)
KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性:KMn04溶液
②为分析气体成分,乙同学取448mL(标准状况)气体Y通人足量溴水中,发生的反应式 为:Br2+SO2+2H20====2HBr+H2S04,然后加入足量BaCl2溶液,经适当操作后得干燥 固体2.33 g
[提出猜想]
分析上述实验中SO2的体积分数的结果,同学们认为Y中还可能含有其它气体并作如下
猜测:
猜想一:Y气体中可能含有H2;
猜想二:
猜想三:
[设计实验,验证猜想]
为验证以上猜想,同学们准备用下列装置设计探究实验(装置可重复使用,夹持仪器省
略)。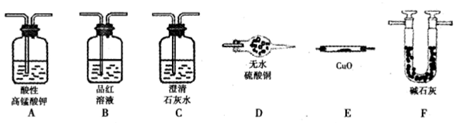
(1)实验装置连接次序为A→ → →F → →F
(2)装置B中试剂作用是 。
(3)猜想一的理由是 (用化学方程式表示)。
(4)如果猜想一成立,预计实验现象应该是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com