本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.雷尼镍(Raney-Ni)是一种历史悠久、应用广泛的催化剂,由镍-铝合金为原料制得.
(1)元素第一电离能:Al
Mg(选填:“>”、“<”、“=”)
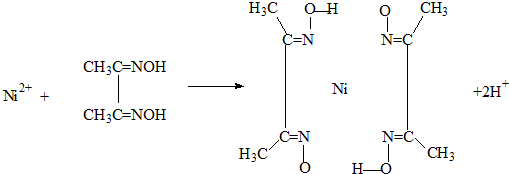
(2)雷尼镍催化的一实例为:

化合物b中进行sp
 3
3杂化的原子有:
.
(3)一种铝镍合金的结构如下图,与其结构相似的化合物是:
(选填序号:a.氯化钠 b.氯化铯 c.石英 d.金刚石).
(4)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀.
①Ni
2+在基态时,核外电子排布式为:
.
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为
B.4-氯苯胺是合成橡胶、化学试剂、染料、色素等化工产品,制备4-氯苯胺的原理如下:

.在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂,

)、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
(1)开始时先通入N
2的目的是
.
(2)上述实验中过滤的目的是
,洗涤所用的试剂是
.
(3)蒸馏时除用到接引管、锥形瓶、温度计外,还用到的玻璃仪器有:
、
.馏出液的主要成分是
.
(4)以下是温度、氢气压力、催化剂用量及吗啉的用量对反应的影响.
|
表1温度 |
|
表2氢气压力 |
|
|
表3催化剂用量 |
|
表4吗啉用量 |
| 序号 |
温度/℃ |
转化率/% |
选择
性/% |
反应时间/h |
序号 |
氢气压力/MPa |
选择性/% |
反应时间/h |
序号 |
雷尼镍用量/g |
选择性/% |
反应时间/h |
序号 |
吗啉用量/% |
选择性/% |
| ① |
40 |
未完全 |
99.6 |
6 |
① |
0.5 |
99.6 |
3.7 |
① |
2 |
98.25 |
5 |
① |
0.0 |
84.3 |
| ② |
60 |
100 |
99.7 |
4 |
② |
1.0 |
99.7 |
2 |
② |
4 |
99.20 |
2.2 |
② |
0.3 |
99.3 |
| ③ |
80 |
100 |
99.6 |
2.45 |
③ |
1.5 |
99.2 |
1.6 |
③ |
6 |
99.60 |
1.9 |
③ |
0.5 |
99.7 |
| ④ |
100 |
100 |
99.6 |
2 |
④ |
2.0 |
96.4 |
1.15 |
④ |
8 |
99.60 |
1.4 |
④ |
0.7 |
99.6 |
| ⑤ |
120 |
100 |
98.6 |
1.7 |
⑤ |
|
|
|
⑤ |
10 |
99.10 |
1.4 |
⑤ |
1.2 |
99.7 |
优化的条件是:温度、氢气压力、催化剂用量、吗啉用量,选择的序号依次是
.


 (2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝. 化合物b中进行sp
化合物b中进行sp 3杂化的原子有:
3杂化的原子有:
 .在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂,
.在1L密闭容器中加入4-氯硝基苯100g、雷尼镍(催化剂)及少量吗啉(脱氯抑制剂, )、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.
)、甲醇250mL(溶剂),密封;先充入氮气,然后充入氢气至一定压力.在所需氢气压力、温度等条件下加氢反应,充分反应后,冷却,过滤,洗涤,蒸馏并收集64~65℃馏分.