
题目列表(包括答案和解析)
Ⅰ.某无色溶液X,由K+、NH![]() 、Ba2+、Al3+、Fe3+、CO
、Ba2+、Al3+、Fe3+、CO![]() 、SO
、SO![]() 中的若干种离子组成,取该溶液进行如下实验:
中的若干种离子组成,取该溶液进行如下实验:
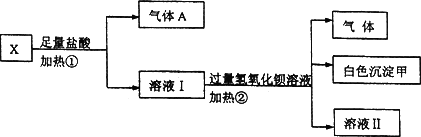
(1)白色沉淀甲是________.
(2)试写出实验过程中生成气体A、B的离子方程式________、________.
(3)通过上述实验,可确定X溶液中一定存在的离子是________,要确定可能存在的离子,需补加的实验是________.
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极.
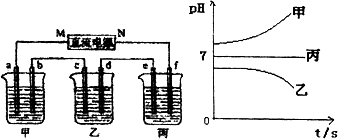
接通电源,经过一段时间后,测得乙中c电极质量增加了16 g.常温下各烧杯中溶液的pH与电解时间t的关系图如上.据此回答下列问题:
(1)M为电源的________极(填写“正”或“负”)电极b上发生的电极反应为________.
(2)计算电极e上生成的气体在标准状况下的体积________;
(3)写出乙烧杯的电解池反应________.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
________
(5)若经过一段时间后,测得乙中c电极质量增加了16 g,要使丙恢复到原来的状态,操作是________.
(Ⅰ)化学平衡移动原理,同样也适用于其他平衡
(1)已知在氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O
 NH+OH-
NH+OH-
向氨水中加入MgCl2固体时,平衡向 移动,OH-的浓度
向浓氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象是___________。
(2)氯化铁水解的离子方程式为___________________,向氯
化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程
式为________________,同时有红褐色沉淀生成,其原因是
_ ___________________________________________________________。
(3)向Mg(OH)2的悬浊液中加入NH4Cl溶液,现象 ,原
因为
。
(Ⅱ)某二元酸 H2A 的电离方程式是:H2A=H++HA,HA- A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)H2A是 (填“强电解质”或“弱电解质”或“非电解质”)
(2)Na2A 溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方
程式表示) ;
(3)NaHA 溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方
程式表示) ;
(4)若 0.1mol·L-1NaHA 溶液的 pH=2,则 0.1mol·L-1 H2A溶液中氢离子的物质
的量浓度可能 0.11mol·L(填“<”、“>”或“=”),理由是: ;
(5)0.1mol·L NaHA溶液中各离子浓度由大到小的顺序是 。
(Ⅰ)化学平衡移动原理,同样也适用于其他平衡
(1)已知在氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O  NH+OH-
NH+OH-
向氨水中加入MgCl2固体时,平衡向 移动,OH-的浓度
向浓氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象是___________。
(2)氯化铁水解的离子方程式为___________________,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为________________,同时有红褐色沉淀生成,其原因是
(3)向Mg(OH)2的悬浊液中加入NH4Cl溶液,现象 ,原
因为
(Ⅱ)某二元酸 H2A 的电离方程式是:H2A=H++HA,HA- A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)H2A是 (填“强电解质”或“弱电解质”或“非电解质”)
(2)Na2A 溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(3)NaHA 溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示) ;
(4)若 0.1mol·L-1NaHA 溶液的 pH=2,则 0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能 0.11mol·L(填“<”、“>”或“=”),理由是: ;
(5)0.1mol·L NaHA溶液中各离子浓度由大到小的顺序是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com