
题目列表(包括答案和解析)
(2)在某温度时,一定量的元素A的气态氢化物AH3,在一定体积的密闭容器中完全分解成两种气体单质,此时压强增加了75%,则A单质的化学式为_________。
(1)9.2 g氮的氧化物NOx中含N原子数为0.2 mol,则NOx的摩尔质量为_________,x数值为_________,同质量的NOx在标准状况下的体积是_________。
(2)在某温度时,一定量的元素A的气态氢化物AH3,在一定体积的密闭容器中完全分解成两种气体单质,此时压强增加了75%,则A单质的化学式为_________。
(15分)氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
I.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式_____。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示)_______________。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。
写出上述化学反应方程式:_________________________。 II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。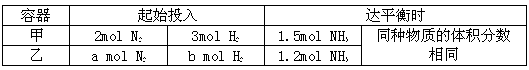
(4)下列能表明容器乙一定达平衡状态的是_____(填字母)
| A.容器内的混合气体的平均相对分子质量不再变化 | |
| B.容器内的氮元素的质量不再变化 | |
C.氢气的生成速率与氨气的消耗速率之比为2:3 | D.形成1mol N N键的同时形成6molN—H键 |
氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
I.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式_____。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示)_______________。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。
写出上述化学反应方程式:_________________________。
![]() II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。

(4)下列能表明容器乙一定达平衡状态的是_____(填字母)
A.容器内的混合气体的平均相对分子质量不再变化
B.容器内的氮元素的质量不再变化
C.氢气的生成速率与氨气的消耗速率之比为2:3
![]() D.形成1mol N N键的同时形成6molN—H键
D.形成1mol N N键的同时形成6molN—H键
(5)甲容器中氮气的转化率为_____。
(6)起始时,容器乙是容器甲压强的_____倍。
 II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。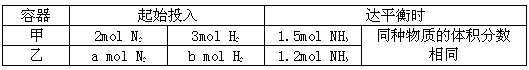
| A.容器内的混合气体的平均相对分子质量不再变化 | |
| B.容器内的氮元素的质量不再变化 | |
C.氢气的生成速率与氨气的消耗速率之比为2:3 | D.形成1mol N N键的同时形成6molN—H键 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com