
题目列表(包括答案和解析)
2000年10月10日,诺贝尔化学奖的桂冠授予美国加利福尼亚大学有机固体研究所所长物理学家AlanJ·Heeger,宾夕法尼亚大学化学家Alan G·MacDiarmid和日本筑波大学化学家Hideki Sbirakawa,以表彰他们杰出的研究导电性塑料的原创性工作.对此惊人的发现,科学家预测,照明用塑料墙纸,手表式计算机等人们梦寐以求的东西将成为现实.
他们是在一次偶然的(操作错误)令人惊喜的实验,一次千载难逢的巧遇后走到一起,合作成功的.
(1)他们的实验原理通式如下,试配平该反应的化学方程式
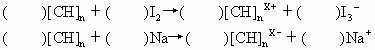
(2)![]() 和
和![]() 形成的物质可以看成________类物质(从无机物分类角度看);
形成的物质可以看成________类物质(从无机物分类角度看);
![]() 类化合物很多,如
类化合物很多,如![]() ,人们称之为卤素互化物.这类物质在化学反应中,既可表现氧化性,也可表现还原性,请完成下列反应方程式
,人们称之为卤素互化物.这类物质在化学反应中,既可表现氧化性,也可表现还原性,请完成下列反应方程式
①![]() →
→
②![]() →
→
(3)现有50.0mL未知浓度的![]() 溶液,实验证明,加入25.0mL 0.010mol/L的
溶液,实验证明,加入25.0mL 0.010mol/L的![]() 溶液,恰好完全反应,请通过计算确定
溶液,恰好完全反应,请通过计算确定![]() 的浓度.(写出计算过程)
的浓度.(写出计算过程)
(4)![]() 是由乙炔在-78℃和催化剂催化下聚合而成的链状分子,请写出乙炔聚合的化学方程式.
是由乙炔在-78℃和催化剂催化下聚合而成的链状分子,请写出乙炔聚合的化学方程式.
卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是_______(填写序号)。
A.氯水中存在两种电离平衡????????????????????
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,c( H+)/c(ClO-)减小???????
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl- )+c(ClO-)
(2)工业上通过氯碱工业生产氯气,其反应的离子方程式为______。
(3)常温下,已知25℃时有关弱酸的电离平衡常数:

写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________。若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因___________。
(4)碘钨灯具有比白炽灯寿命长且环保节能的;特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:  。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则

①该反应的△H_______0(填“>。、=或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)=_________。
③下列说法中不正确的是_________(填序号),
A.利用该反应原理可以提纯钨
B.该反应的平衡常数表达式是K=
C.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
(5)25℃时,向5mL含有KCI和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是_________,溶液中离子浓度由大到小的顺序是_______ [不考虑H+和OH-。25℃时
 ]。
]。
为测定月球上钛铁矿的组成,称取1.53g样品,在高温下通入足量的H2还原,并最终收集到0.180g水.将反应后残渣加入足量浓氢氧化钠溶液中,充分溶解后过滤,将所得滤渣洗涤、烘干后称量得0.570g;将滤渣的一半溶于过量的稀硝酸,并过滤除去0.0100g不溶物后配制成50.0mL溶液;向其一半溶液中加入少许KSCN溶液,显红色;余下的25.0mL溶液中如果加入过量NaOH稀溶液,则生成红褐色沉淀,将沉淀过滤洗涤、灼烧后得0.200g固体.已知钛元素在钛铁矿中呈最高价;钛元素最高价氧化物不与H2在高温下反应,却能溶于浓碱中.回答下列问题:
(1)计算钛铁矿样品中氧元素的质量分数;
(2)写出钛铁矿与H2发生反应的化学方程式;
| A、30 mL | B、45 mL | C、50 mL | D、65 mL |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com