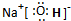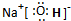A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同主族元素.A、F两元素的原子核中质子数之和比C、D两元素的原子核中质子数之和少2.F元素的最外层电子数是其次外层电子数的
.又知B元素的最外层电子数是内层电子数的2倍.E元素的最外层电子数等于其电子层数.请回答:
(1)写出元素A和B形成的直线型非极性分子的电子式:
.
(2)已知:泡沫灭火器的工作原理是含有A、B、C、D四种元素形成的化合物X和含有C、E、F三种元素形成的Y的水溶液间的反应,写出该反应的离子方程式:
3HCO3-+Al3+═3CO2↑+Al(OH)3↓
3HCO3-+Al3+═3CO2↑+Al(OH)3↓
.
(3)工业上制备单质E,是通过电解C和E形成的化合物;写出阴极上的电极反应式:
Al3++3e-═Al
Al3++3e-═Al
.
(4)1mol由E、F两种元素组成的化合物跟由A、C、D三种元素组成的化合物的溶液恰好完全反应,则消耗后者化合物的物质的量为
8
8
mol.
(5)含有溶质为DAB
2C
4的水溶液显酸性的原因是
HC2O4-的电离大于水解
HC2O4-的电离大于水解
.
(6)若G是周期表中第四周期第Ⅷ族的金属元素,其最高价氧化物与单质E反应的化学方程式是
.