
A、B、C、X是中学化学1中常见的4种物质,它们均由短周期元素组成,转化关系如图所示.请针对以下两种情况1回答下列问题:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在.将A、C的水溶液混合可得白色胶状沉淀B.
①A中含有的金属元素为
铝
铝
(填元素名称).
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,此反应的化学方程式为
.
(2)若A、B、C的焰色反应均呈黄色,水溶液均呈碱性.
①A中所含有的化学键是
离子键
离子键
、
共价键
共价键
.
②将4.48L(标准状况下)X通入100mL 3mol?L
-1A的水溶液后,溶液中离子浓度由大到小的顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.
③自然界中存在由B或C与H
2O按一定比例结晶而成的固体.将一定量的由C与H
2O按一定比例形成的晶体溶于水配制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol?L
-1.若取相同质量的此晶体加热至恒重,剩余固体的质量为
2.65g
2.65g
.

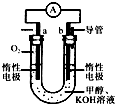 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景. A、B、C、X是中学化学1中常见的4种物质,它们均由短周期元素组成,转化关系如图所示.请针对以下两种情况1回答下列问题:
A、B、C、X是中学化学1中常见的4种物质,它们均由短周期元素组成,转化关系如图所示.请针对以下两种情况1回答下列问题: