
题目列表(包括答案和解析)
| 催化剂 |
| 140℃ |
| 催化剂 |
| 140℃ |
| 催化剂 |
| 140℃ |
| 催化剂 |
| 140℃ |
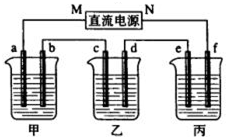 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:(1)在标准状况下,能否用上述数据确定参加反应的CO2的体积?若能,试列式计算;若不能,请说明理由。
(2)能否用以上的数据确定NaOH物质的量浓度?若在上述CO2与NaOH反应后的溶液中不加入石灰水,而是加入足量CaCl2溶液,结果得到n g沉淀,设原NaOH溶液的物质的量浓度为c,则
当n=m时,c=______________________________________________;
当n=0时,c=______________________________________________;
当n<m时,c=_____________________________________________。
|
![]() 回答下列问题:
回答下列问题:
![]() (1)在(A)情况下,溶质为(写化学式) ,其物质的量之比为 ,在标准状况下,通人CO2气体的体积为 。
(1)在(A)情况下,溶质为(写化学式) ,其物质的量之比为 ,在标准状况下,通人CO2气体的体积为 。
![]() (2)在(B)情况下,溶质为(写化学式) ,其物质的量之比为 ,在标准状况下,通人CO2气体的体积为 。
(2)在(B)情况下,溶质为(写化学式) ,其物质的量之比为 ,在标准状况下,通人CO2气体的体积为 。
![]() (3)原NaOH溶液的物质的量浓度为 。
(3)原NaOH溶液的物质的量浓度为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com