
题目列表(包括答案和解析)
(8分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等。请回答下列问题:
(1)T的原子结构示意图为________。
(2)元素的非金属性(原子的得电子能力):Q________W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为__________________________。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是________________。
(6)在298K下,Q、T的单质各1 mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3mol Q的单质,则该反应在298K下的ΔH=________(注:题中所涉单质均为最稳定单质)。
(10分)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为______________.
(2)该反应达到平衡时H2的转化率________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为____________.(填序号)
A、0.20 mol·L-1 b、0.12 mol·L-1 c、0.10 mol·L-1 d、0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时NH3的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(N2)、n(H2)、n(NH3)分别为a、b、c,则a、b、c之间应该满足的关系式为:
(6)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>” “=” 或 “<” )。
(10分)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
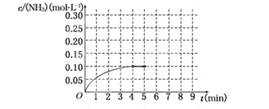
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为______________.
(2)该反应达到平衡时H2的转化率________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为____________.(填序号)
A、0.20 mol·L-1 b、0.12 mol·L-1 c、0.10 mol·L-1 d、0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时NH3的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(N2)、n(H2)、n(NH3)分别为a、b、c,则a、b、c之间应该满足的关系式为:
(6)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>” “=” 或 “<” )。
(10分)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: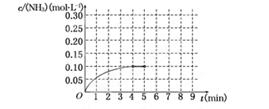
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为______________.
(2)该反应达到平衡时H2的转化率________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为____________.(填序号)
A、0.20 mol·L-1 b、0.12 mol·L-1 c、0.10 mol·L-1 d、0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时NH3的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(N2)、n(H2)、n(NH3)分别为a、b、c,则a、b、c之间应该满足的关系式为:
(6)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>” “="”" 或 “<” )。
(8分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等。请回答下列问题: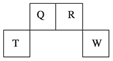
(1)T的原子结构示意图为________。
(2)元素的非金属性(原子的得电子能力):Q________W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为__________________________。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是________________。
(6)在298K下,Q、T的单质各1 mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3 mol Q的单质,则该反应在298K下的ΔH=________(注:题中所涉单质均为最稳定单质)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com