

题目列表(包括答案和解析)
- 3 |
- 3 |
- 3 |
- 3 |
(9分)在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
|
成分 |
质量(g) |
摩尔质量(g ·mol-1) |
|
蔗糖 |
25.00 |
342 |
|
硫酸钾 |
0.25 |
174 |
|
阿司匹林 |
0.17 |
180 |
|
高锰酸钾 |
0.25 |
158 |
|
硝酸银 |
0.02 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为_______ mol/L。(注意:只要求用原始数据写表达式,不需要化简与计算)
(3)配制上述“鲜花保鲜剂”所需的仪器有:烧杯、电子天平、药匙、________________、______________、_______________。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(12分)利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
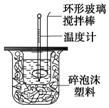
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高
温度。回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为
57.3 kJ/mol):_______________________________________________。
(2)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
|
温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
|
2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
|
4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(共9分,每空1分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
。
(2)B为0.1mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方
程式表示): ; ;
实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:
。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为
。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
AgCl(S) Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10
25℃时,现将足量氯化银分别放入:①100mL蒸馏水中;②100mL 0.2 mol·L-1AgNO3溶液中;③100mL 0.1 mol·L-1氯化铝溶液中;④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1
(9分)在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 | 质量(g) | 摩尔质量(g ·mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com