
题目列表(包括答案和解析)
在实验室制各氯气的实验中:制法
(1)反应原理(方程式)为________
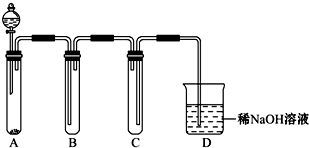
(2)实验装置如图所示

指出下列装置中所盛试剂及其作用:
C.________ ________
D.________ ________
F.________ ________
| 压强MPa 转化率% 温度℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.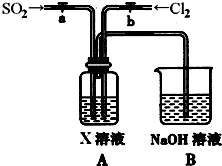
二氧化硫在工业制硫酸中有着重要作用,但又是煤燃烧的有害气体.按“循环经济”的模式,就是要将SO2收集起来,把它变为有用的东西.
(1)某空气监测是根据SO2和溴水的定量反应来测定SO2的含量.该反应的化学方程式为______.
(2)若每次取样的空气为200mL,通人足量的溴水中,测得平均有2.408×1018个电子转移,则SO2的含量为______mg?L-1,若规定空气中SO2含量不得超过0.02mg?L-1,则样气是否符合大气的质量标准______(填“符合”或“不符合”).
(3)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O-2e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2+2e-→2Cl-.在上述两个反应中均会生成产物X,则X的化学式为______.
A. NaClO B.NaClO4 C.HClO D.ClO2
(4)在硫酸工业制法中,下列叙述正确的是______.
A.硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D.SO3用98.3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提高SO3吸收效率
(5)如表是压强对SO2平衡转化率的影响
| 压强MPa 转化率% 温度℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
对于SO2转化SO3的反应,增大压强可使转化率______(填“增大”、“减少”或“不变”),但在实际工业生产中常采用常压条件,理由是______.
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com