
题目列表(包括答案和解析)
(09盐城第三次调研)在Ni、NiO、Ni3C、γ-Al2O3组成的催化剂表面,可实现H2O、CO2及CH4合成乙醇。
 (1)下列说法正确的是 (选填序号)。
(1)下列说法正确的是 (选填序号)。
A.第一电离能:碳原子大于氧原子
B.CO2分子中含有2个σ键和2个π键
C.CH4分子中碳原子采用sp3杂化
D.二甲醚的沸点比乙醇高
(2)镍原子基态时的核外电子排布式 。
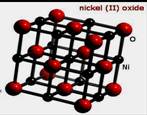
(3)NiO晶胞如右上图所示,每个晶胞中与每个Ni2+距离相等且最近的Ni2+有 个,某种有缺陷的氧化镍晶体
由Ni2+、Ni3+、O2-及空隙组成,可表示为Ni0.98O,则n(Ni2+)/n(Ni3+)= 。
(4)对苯二甲酸( ![]() )、4,4’-联吡啶[
)、4,4’-联吡啶[![]() (可简化为
(可简化为 ![]() )]等与Ni2+能形成多核配合物。配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如下图:
)]等与Ni2+能形成多核配合物。配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如下图:

该络合物中配位原子是: ;依据价层互斥理论,ClO4-空间结构为 型。
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
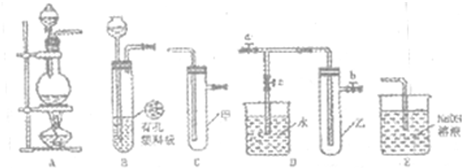
(Ⅰ)某化学兴趣小组的同学得上用下图所示实验装置进行实验(图中a、b、c表示止水夹)。

(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱。
①选择合理的装置连接: → → (填字母编号)。
②选择所需的试剂: (填字母编号)。
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论: 。
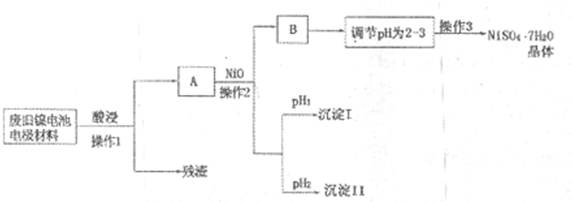
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4·7H2O晶体,设计实验流程如下:

已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
|
M(OH)n |
Ksp[来源:学_科_网][来源:学#科#网Z#X#X#K] |
pH |
|
|
开始沉淀 |
沉淀完全 |
||
|
Al(OH)3 |
1.9×10-23 |
3.43 |
4.19 |
|
Fe(OH)3 |
3.8×10-38 |
2.53 |
2.94 |
|
Ni(OH)2 |
1.6×10-14 |
7.60 |
9.75 |
回答下列问题:
(1)根据上表数据判断操作2依次析出的沉淀I是 沉淀II是 (填化学式),pH1 pH2(填“>”、“<”或“=”);
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。
(3)“调节pH为2-3”的目的是 ;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式是 。
(Ⅰ)某化学兴趣小组的同学得上用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱。
①选择合理的装置连接: → → (填字母编号)。
②选择所需的试剂: (填字母编号)。
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论: 。
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4·7H2O晶体,设计实验流程如下:
已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
| M(OH)n | Ksp[来源:学_科_网] | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(1)根据上表数据判断操作2依次析出的沉淀I是 沉淀II是 (填化学式),pH1 pH2(填“>”、“<”或“=”);
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。
(3)“调节pH为2-3”的目的是 ;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com