
题目列表(包括答案和解析)
A、B为两种单质,常温下均是固体。在元素周期表中A、B为前18号元素中的两种。分别取三份质量为1.52 g的A、B的混合物(粉末)进行如下实验。(本题中所有的气体体积均指标准状况下的体积)
(a)向第一份试样中加入过量的盐酸,充分反应后放出0.896 L气体,还余下0.56 g残渣;
(b)向第二份试样中加入过量的10%的NaOH溶液,充分反应后放出0.896 L气体,还余下0.96 g残渣;?
(c)将第三份试样隔绝空气加强热后,生成一种固体,冷却后再加入足量的盐酸,该固体全部溶解,产生x L气体。
(1)单质A是__________。
(2)混合物中的B的质量分数是__________。
(3)写出实验(c)中有关反应的化学方程式并计算x的值。
A、B为两种单质,常温下均是固体。在元素周期表中A、B为前18号元素中的两种。分别取三份质量为1.52 g的A、B的混合物(粉末)进行如下实验。(本题中所有的气体体积均指标准状况下的体积)
(a)向第一份试样中加入过量的盐酸,充分反应后放出0.896 L气体,还余下0.56 g残渣;
(b)向第二份试样中加入过量的10%的NaOH溶液,充分反应后放出0.896 L气体,还余下0.96 g残渣;?
(c)将第三份试样隔绝空气加强热后,生成一种固体,冷却后再加入足量的盐酸,该固体全部溶解,产生x L气体。
(1)单质A是__________。
(2)混合物中的B的质量分数是__________。
(3)写出实验(c)中有关反应的化学方程式并计算x的值。
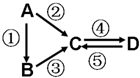 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com