
题目列表(包括答案和解析)
如下图所示,用铅蓄电池电解100g 10.0%的硫酸钠溶液,经过一段时间后,测得溶液质量变为95.5g。下列说法正确的是
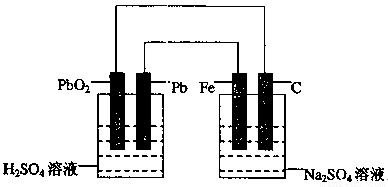
A.电路中转移0.25mol电子
B.铅蓄电池中消耗0.5mol H2SO4
C.铅蓄电池的负极反应式为:PbSO4+2H2O—2e-=PbO2+4H++SO2-4
D.Fe电极发生的电极反应为Fe—2e-=Fe2+
如下图所示,用铅蓄电池电解100g 10.0%的硫酸钠溶液,经过一段时间后,测得溶液质量变为95.5g。下列说法正确的是
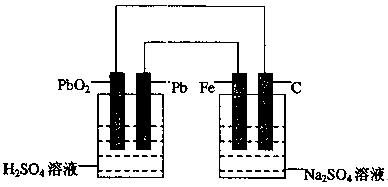
A.电路中转移0.25mol电子
B.铅蓄电池中消耗0.5mol H2SO4
C.铅蓄电池的负极反应式为:PbSO4+2H2O—2e-=PbO2+4H++SO2-4
D.Fe电极发生的电极反应为Fe—2e-=Fe2+
如下图所示,用铅蓄电池电解100g 10.0%的硫酸钠溶液,经过一段时间后,测得溶液质量变为95.5g。下列说法正确的是
A.电路中转移0.25mol电子
B.铅蓄电池中消耗0.5molH2SO4
C.铅蓄电池的负极反应式为:PbSO4+2H2O—2e-=PbO2+4H++SO2-4
D.Fe电极发生的电极反应为Fe—2e-=Fe2+
如下图所示,用铅蓄电池电解100g 10.0%的硫酸钠溶液,经过一段时间后,测得溶液质量变为95.5g。下列说法正确的是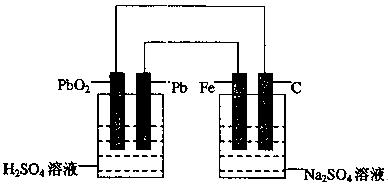
| A.电路中转移0.25mol电子 |
| B.铅蓄电池中消耗0.5mol H2SO4 |
| C.铅蓄电池的负极反应式为:PbSO4+2H2O—2e-=PbO2+4H++SO2-4 |
| D.Fe电极发生的电极反应为Fe—2e-=Fe2+ |
 熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO32--52e-═34CO2+10H2O.试回答下列问题:
熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO32--52e-═34CO2+10H2O.试回答下列问题:
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com