
题目列表(包括答案和解析)

(Ⅰ)实验室有贮存以下物质的方法,其中正确的是 (填序号)
①氢氟酸保存在细口玻璃瓶中
②浓硝酸用棕色瓶盛放,贮存在阴凉处
③少量液溴可用水封存,防止溴挥发
④氢氧化钠溶液贮存在带磨口玻璃塞的玻璃试剂瓶中
⑤在实验室少量的金属钠保存在煤油中
(Ⅱ)实验室需要480mL0.2mol·L-1的FeSO4溶液做实验,在配制FeSO4溶液时的操作步骤为:
①用天平称取一定质量的绿矾(FeSO4·7H2O),把它放在某仪器中,用适量的蒸馏水使其完全溶解;
②把制得的溶液小心的注入某仪器中;
③继续向某仪器中滴加蒸馏水至液面距刻度线1~2cm处时,改用某仪器小心滴加,直到溶液的凹液面恰好与刻度线相切为止;
④用蒸馏水洗涤某仪器2~3次,每次的洗涤液都转入某仪器中,并轻轻摇匀;
⑤将某仪器塞好,充分摇匀。
请填写下列空白:
(1)用托盘天平称取的绿矾的质量为: ;
(2)上述操作的正确顺序为: ;
(3)本次实验用到的玻璃仪器有: ,
(4)在观察液面定容时,若俯视刻度线,会使所配制的溶液的浓度 ;
加蒸馏水时不慎超过了刻度线后倒出部分溶液,使液面与刻度线相切,会 。
〔填“偏高”、“偏低”或“无影响”)
(5)用密度ρ=1.84g·mL-1,质量分数为98%的浓硫酸配制250mL1mol·L-1的稀硫酸与上述配制溶液的步骤上的差别有:
①计算:理论上应用量筒量取浓硫酸的体积V= mL;
②量取:由于量筒是一种粗略的量具,如想精确量取,必需选用 (填仪器名称)。
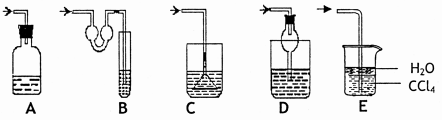
(Ⅲ)下图各种尾气吸收装置中,适合于吸收HCI气体,而且能防止倒吸的有 。

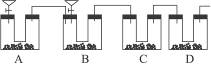
通过仔细分析,该同学重新设计了一套装置(如下图所示)(实验室可供选择的试剂和药品有锌片、浓硫酸、氢氧化钙溶液、碳酸钙固体、蒸馏水)。

完成下列问题:
(1)请分析在实验改进前,实验中出现较大偏差的原因:______________________________。
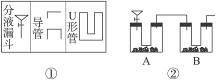
(2)在改进后的实验中,A装置分液漏斗中所盛的液体为__________,U形管内盛有。在整套装置中,A的作用是__________________________;D装置中U形管内盛有__________,D装置在整套装置中的作用是_____________________。
(3)该同学新设计的实验装置(如上图所示)是否完整?如果不完整,请画出应该补充的装置简图,并在图中标明所用药品或试剂。
某学生用实验方法来分析碳酸钠的纯度。该同学设计出如图②所示的实验装置(各符号代表的仪器如图①所示),其中A中盛有一定量的碳酸钠样品,分液漏斗内盛装稀硫酸,B内为碱石灰固体。他利用碱石灰的增重求出纯净的碳酸钠质量,再求纯度。重复正确操作3次,结果出现较大的偏差。
通过仔细分析,该同学重新设计了一套装置(如下图所示)(实验室可供选择的试剂和药品有锌片、浓硫酸、氢氧化钙溶液、碳酸钙固体、蒸馏水)。
完成下列问题:
(1)请分析在实验改进前,实验中出现较大偏差的原因:______________________________。
(2)在改进后的实验中,A装置分液漏斗中所盛的液体为__________,U形管内盛有。在整套装置中,A的作用是__________________________;D装置中U形管内盛有__________,D装置在整套装置中的作用是_____________________。
(3)该同学新设计的实验装置(如上图所示)是否完整?如果不完整,请画出应该补充的装置简图,并在图中标明所用药品或试剂。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com