
题目列表(包括答案和解析)



| 放电 | 充电 |
(1)常温下,X、Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是__________。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式_______________________________________。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为_______________________________________。
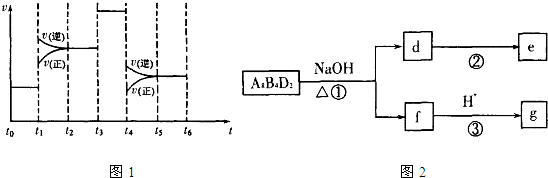
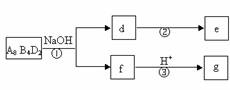
(4)化学反应![]() 2CA3(g)。
2CA3(g)。
当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是________________________。温度为T ℃时,将

(5)化合物A8B4D2有如下转化关系:

其中,g是常用调味品的主要成分。写出反应①的化学方程式__________________________。
设计实验方案完成d→e的转化____________________________________________________。
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为 。
(4)化学反应3A2(g)+C2(g) ![]() 2CA3(g)。当反应达到平衡时不断
2CA3(g)。当反应达到平衡时不断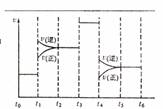
改变条件(不改变A2、C2和CA3的量),右图表示反应速度与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。温度为T℃时,将4amolA2和2amolC2放入密闭容器中,充分
反应后测得C2的转化率为50%,则反应的平衡常数 。
(5)化合物A8B4D2有如下转化关系:
其中,g是常用调味品的主要成分。写出反应①的化学方程式
。
设计实验方案完成d→e的转化
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com