
题目列表(包括答案和解析)
| 实验操作 | 预期现象和结论 |
| 步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用. | 有不溶的黑色固体. |
| 步骤2:取适量步骤1清液于试管中, |
|
| 步骤3: |
| 滴定 次数 |
待测溶液 的体积/mL |
消耗标准盐酸的体积 | |
| V1/mL | V2/mL | ||
| 1 | 25.00 | 15.02 | 4.97 |
| 2 | 25.00 | 14.98 | 5.03 |
| 3 | 25.00 | 13.21 | 6.75 |
根据镁与二氧化碳的反应推测,钠也能在二氧化碳中燃烧,且固体产物可能为碳酸钠、氧化钠、碳中的两种或三种。某兴趣小组对钠在二氧化碳中燃烧后的产物进行定性和定量探究。
(1)假设产物为Na2CO3、Na2O和C的混合物,设计实验方案,验证其中的Na2CO3和Na2O。在答题卡上写出实验步骤、预期现象和结论。(已知室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、BaCl2溶液、Ba(OH)2溶液、精密pH试纸(精确至0.1)、烧杯、试管、滴管、玻璃棒、表面皿、比色卡
|
实验操作 |
预期现象和结论 |
|
步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用。 |
有不溶的黑色固体。 |
|
步骤2:取适量步骤1清液于试管中,
|
|
|
步骤3:
|
|
(2)假设产物为Na2CO3、Na2O和C的混合物,为进一步测定产物中Na2CO3的含量,进行了以下实验:
步骤1:准确称取w克试样,溶解、过滤后准确配制成250mL溶液。
步骤2:准确量取25.00mL所配溶液于锥形瓶中,滴加几滴指示剂A,滴加c mol/L的标准盐酸至溶液的pH约为8.2(碳的主要存在形式为HCO3―),消耗盐酸的体积为V1mL;再滴加几滴甲基橙,继续用上述盐酸滴至溶液由黄色变橙色,消耗盐酸的体积为V2mL。
步骤3:重复实验3次。滴定结果如下
|
滴定 次数 |
待测溶液 的体积/mL |
消耗标准盐酸的体积 |
|
|
V1/mL |
V2/mL |
||
|
1 |
25.00 |
15.02 |
4.97 |
|
2 |
25.00 |
14.98 |
5.03 |
|
3 |
25.00 |
13.21 |
6.75 |
①步骤2中,第一步滴定所使用的A指示剂为 ,滴定终点的现象为 。
②计算Na2CO3的质量分数= (用含w、c的代数式表示)
(13分)根据镁与二氧化碳的反应推测,钠也能在二氧化碳中燃烧,且固体产物可能为碳酸钠、氧化钠、碳中的两种或三种。某兴趣小组用如下装置开展两个阶段的实验探究。
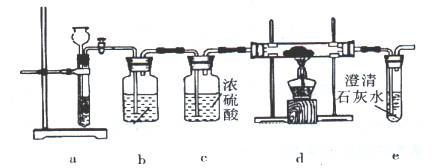
I、引发CO2与Na反应。操作步骤为:①按图连接装置,检验气密性,并往各装置中加入试剂;②打开装置a上活塞一段时间;③点燃d处酒精灯,使CO2与Na充分反应。停止加热,继续通气体使双通直管冷却。回答下列问题:
(1)操作①时,装置b中装入的试剂是 ;
(2)步骤②时,当观察到 时,才能进入步骤③。
Ⅱ:探究反应产物及反应机理。取反应后双通管中固体物质29.2g进行如下实验:
①仔细观察固体,发现有黑色颗粒;
②将固体溶于足量的水并过滤、洗涤,得到1.8 g滤渣(干燥);
③将滤液加水稀释配成250ml的溶液;
④取少量③的溶液,先加足量BaCl2溶液,再加酚酞试液,观察到白色沉淀及溶液变红;
⑤取25.0mL③的溶液,用3.0mol·L-1盐酸滴定,消耗盐酸20.00mL。回答下列问题:
(3)反应后装置d中的固体物质为
(4)通过计算分析:29.2g残留固体中,各组分的质量各是多少?
(5)该探究条件下,钠与二氧化碳反应的化学方程式为 。
根据镁与二氧化碳的反应推测,钠也能在二氧化碳中燃烧,且固体产物可能为碳酸钠、氧化钠、碳中的两种或三种。某兴趣小组对钠在二氧化碳中燃烧后的产物进行定性和定量探究。
(1)假设产物为Na2CO3、Na2O和C的混合物,设计实验方案,验证其中的Na2CO3和Na2O。在答题卡上写出实验步骤、预期现象和结论。(已知室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、BaCl2溶液、Ba(OH)2溶液、精密pH试纸(精确至0.1)、烧杯、试管、滴管、玻璃棒、表面皿、比色卡
| 实验操作 | 预期现象和结论 |
| 步骤1:取适量产物样品于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,取上层清液备用。 | 有不溶的黑色固体。 |
| 步骤2:取适量步骤1清液于试管中, | |
| 步骤3: | |
| 滴定 次数 | 待测溶液 的体积/mL | 消耗标准盐酸的体积 | |
| V1/mL | V2/mL | ||
| 1 | 25.00 | 15.02 | 4.97 |
| 2 | 25.00 | 14.98 | 5.03 |
| 3 | 25.00 | 13.21 | 6.75 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com