
题目列表(包括答案和解析)
 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为Ⅰ.(4分)铜与稀硝酸反应的离子方程式为________________;在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是________________;为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐,那么加入少量碳酸盐的作用是________________。
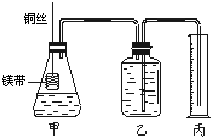
Ⅱ.某研究性学习小组欲证明:在同温同压下,相同浓度、相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:

①配制浓度均为1 mol?L-1盐酸和醋酸溶液;
②量取15.00 mL 1 mol?L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录相关数据;
⑥反应结束后待温度恢复到室温,调整乙和丙中液面使二者处于同一平面,读出量筒中水的体积为V mL。
请你参与实验并回答下列问题:
(1)量取15.00 mL 1 mol?L-1盐酸和醋酸溶液所用的仪器是 ;
A.带刻度的烧杯 B.量筒 C.酸式滴定管 D.碱式滴定管
(2)步骤③中a的数值至少是 ;步骤④中检查该装置气密性的操作与观察方法是:____________________;步骤⑤中应记录的数据是 ;
(3)本实验装置丙中量筒的规格是 (填序号)。
A.10mL B.100 mL C.200 mL D.500 mL
(4) 若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=____;
(5)试简述速率不等的原因是_________;铜丝不与酸接触的原因是_______________。
(6)试写出镁与醋酸溶液反应的离子方程式: 。
下列离子方程式的书写正确的是
A.实验室用浓盐酸与MnO2反应制Cl2:
MnO2 +4HCl(浓)![]() Cl2↑+Mn2+ +2Cl-+2H2O
Cl2↑+Mn2+ +2Cl-+2H2O
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH—+H++ SO42—+ NH4+ =BaSO4↓+ NH3·H2O +H2O
C.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
Ca2++ HCO3—+OH—=CaCO3↓+H2O
D.铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO↑+ 4H2O
下列离子方程式书写正确的是
A.将铜屑加入Fe3+溶液中:Fe3++Cu=Fe2++Cu2+
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH- NH3↑+H2O
NH3↑+H2O
C.稀硝酸和过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
D.KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+ =2H2O+I2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com