
题目列表(包括答案和解析)
氢是重要而洁净的能源。要利用氢气做能源,必须解决好安全有效地储存氢气的问题,化学家研究出利用金属或合金来储存氢气的方法。金属是紧密堆积结构,结构中存在许多四面体和八面体空隙,氢原子可以填入空隙中而被储存起来,MgH2就是一种储氢材料。金属镁属六方晶系,晶胞结构如图所示(a=3.20×10-8cm,c=5.22×10-8cm),回答下列问题:
(1)每个晶胞含有 个镁原子。
(2)晶胞的体积是 g·cm-3。
(3)储氢材料MgH2表示2个H原子填入空隙中,假定Mg吸氢后体积不变,则MgH2中氢的密度是 。
(4)在标准状况下,1体积镁可储存 体积的氢气。
短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1:1的离子化合物A,X与Z能形成原子个数比为1:1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
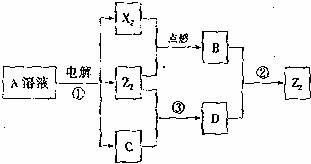
(1)Y在周期表的位置是 ; Z2的电子式是 。
(2)反应①的化学方程式是 。
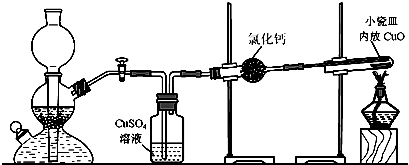
(3)D溶液呈碱性的原因是(用离子方程式表示) ;D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z3,仪器装置如图所示(夹持固定装置的仪器已略去)。
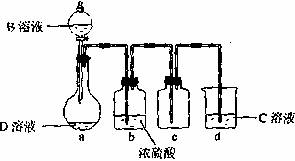
I.反应②的离子方程是 。
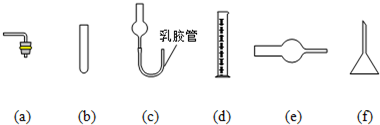
II.上述实验装置不够完善,改进方法是 。
(4)Z2跟C在常温时发生的反应③,在加热条件下发生的反应是:
3Z2+6C ![]() 5A+YZO3+3H2O,3molZ2与足量的C溶液反应,转移电子的物质的量n(e―)的取值范围是 。
5A+YZO3+3H2O,3molZ2与足量的C溶液反应,转移电子的物质的量n(e―)的取值范围是 。
| A、液氮的沸点为-195.8℃,远低于常温 | B、氮气与氧气反应放热 | C、氮气在空气中燃烧放热 | D、氮气在空气中约占78%(体积分数) |
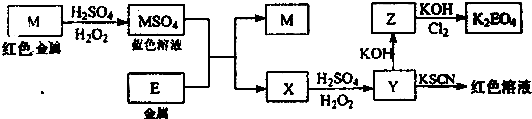
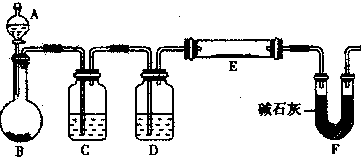
| 16(w-m) |
| n-w |
| 16(w-m) |
| n-w |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com