
题目列表(包括答案和解析)
 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg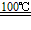 HgBr2+H2
HgBr2+H2  HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑
2Hg+O2↑ 

 氢气是中学化学中常见的气体之一,它是一中新型的绿色能源,又是一种重要的化工原料.
氢气是中学化学中常见的气体之一,它是一中新型的绿色能源,又是一种重要的化工原料.
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
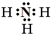
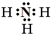
 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应N2(g)+3H2(g) 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
|
化学键 |
H-H |
N-H |
N≡N |
|
键能/kJ·mol-1 |
436 |
a |
945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
② H2O(g)=H2O(l) ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。
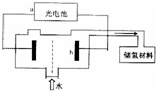
(3)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
①写出燃料电池正极的电极反应式 。②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是 极(填”A”或”B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为 L。

(4)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为 ,单位时间内通过阴离子交换膜的离子数与通过阳离子交换膜的离子数的比值为 。
②从出口D导出的溶液是 (填化学式)。
(15分)科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是 。(选填字母)
| A.电解水 | B.锌和稀硫酸反应 |
| C.光解海水 | D.分解天然气 |

 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1 CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1 CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1 CH3OCH3(g) + CO2 (g)的ΔH=
CH3OCH3(g) + CO2 (g)的ΔH= 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com