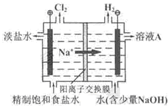
(2011?北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示.
(1)溶液A的溶质是
NaOH
NaOH
.
(2)电解饱和食盐水的离子方程式是
.
(3)电解时用盐酸控制阳极区溶液的pH在2~3.用化学平衡移动原理解释盐酸的作用:
Cl
2与水的反应为Cl
2+H
2O

HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl
2在水中的溶解,有利于Cl
2的逸出
Cl
2与水的反应为Cl
2+H
2O

HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl
2在水中的溶解,有利于Cl
2的逸出
.
(4)电解所用的盐水需精制,去除有影响的Ca
2+、Mg
2+、NH
4+、SO
42-[c(SO
42-)>c(Ca
2+)].精制流程如下(淡盐水和溶液A来自电解池):
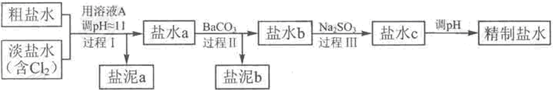
①盐泥a除泥沙外,还含有的物质是
Mg(OH)2
Mg(OH)2
.
②过程I中将NH
4+转化为N
2的离子方程式是
2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O
2NH4++3Cl2+8OH-═N2↑+6Cl-+8H2O
.
③BaSO
4的溶解度比BaCO
3的小.过程II中除去的离子有
SO42-、Ca2+
SO42-、Ca2+
.
④经过程III处理,要求盐水c中剩余Na
2SO
3的含量小于5mg/L.若盐水b中NaClO的含量是7.45mg/L,则处理10m
3盐水b,至多添加10% Na
2SO
3溶液
1.76
1.76
kg(溶液体积变化忽略不计).

 (2011?北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示.
(2011?北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示. HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出 HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出