【物质结构与性质】
(1)金属镁有许多重要的用途,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如下图:


上述2种结构中均存在配位键,把你认为是配位键的用“→”标出.
(2)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
F>Cl>S
F>Cl>S
(用元素符号表示)
(3)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
+3
+3
;第二电离能(I
2)B小于A的原因是
A+外层电子排布为2s22p6稳定结构,难再失去一个电子.B+外层电子排布为3s1,易失去一个电子
A+外层电子排布为2s22p6稳定结构,难再失去一个电子.B+外层电子排布为3s1,易失去一个电子
.
| 电离能/kJ?mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
500 |
4600 |
6900 |
9500 |
| B |
740 |
1500 |
7700 |
10500 |
| C |
580 |
1800 |
2700 |
11600 |
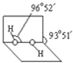
(4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
sp3
sp3
杂化;通常情况下,H
2O
2与水任意比互溶的主要原因是
H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
.
(5)R是1~36号元素中未成对电子数最多的原子.R
3+在溶液中存在如下转化关系:

①基态R原子的价电子排布式为
3d54s1
3d54s1
.
②[R(OH)
4]
-中存在的化学键是
BD
BD
.
A.离子键 B.极性键 C.非极性键 D.配位键.



 (4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
(4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取