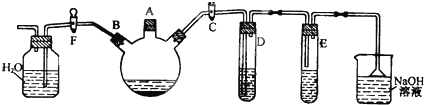
某同学运用已有的Na
2O
2和CO
2反应的知识进行迁移,认为Na
2O
2也可和SO
2反应,反应式可能为2Na2O
2+2SO
2=2Na
2SO
3+O
2,为此设计如下一套装置,来验证Na
2O
2和SO
2的反应产物.如图安装仪器,检查装置气密性后添加药品并滴入适量浓硫酸,回答下列问题:
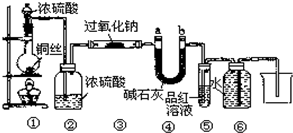
(1)点燃①处酒精灯,不久,观察到①处产生大量气体;③处两通管管壁发热,管内药品的颜色变化为
淡黄
淡黄
色逐渐变为
白
白
色.
(2)在反应过程中如何用较简便的操作证明反应产生了O
2?
打开④处U型管a处橡皮塞,插入带火星的木条,如果复燃,说明产生了O2
打开④处U型管a处橡皮塞,插入带火星的木条,如果复燃,说明产生了O2
.
(3)⑥处用排水法收集气体,从什么现象可证明收集的气体中已不含SO
2?
⑤处品红溶液不褪色,说明氧气中不混有二氧化硫
⑤处品红溶液不褪色,说明氧气中不混有二氧化硫
.
(4)待反应结束后,取两通管内少量固体,装入试管中,加水溶解时未产生气体,如何证明产物中有Na
2SO
3?
加入盐酸,若有刺激性气味的气体逸出,则证明产物中含有Na2SO3
加入盐酸,若有刺激性气味的气体逸出,则证明产物中含有Na2SO3
.
(5)待反应结束后,取两通管内少量固体,装入试管中,加入足量盐酸溶液,再加入氯化钡溶液,有白色沉淀生成,试分析产生沉淀的原因.
由于过氧化钠有氧化性,反应过程中有部分亚硫酸钠被氧化为Na2SO4和BaCl2反应产生难溶于盐酸的BaSO4
由于过氧化钠有氧化性,反应过程中有部分亚硫酸钠被氧化为Na2SO4和BaCl2反应产生难溶于盐酸的BaSO4
.