
题目列表(包括答案和解析)
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比
是 .
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与
足量的Ba(OH)2溶液反应的离子方程式 .
(3)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g)
2CA3(g)
ΔH=-92.4 kJ·mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,总容积为1.0 L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol,A2 0.5mol,CA3 0mol B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.5mol/L,A2 0.3mol/L,CA3 0.2mol/L
②若起始加入1.2molC2、1.0molA2,达平衡后C2的浓度为__________mol/L
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将________(填“正向”、“逆向”或“不”)移动.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ▲ ;砷与溴的第一电离能较大的是 ▲ 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 ▲ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ▲ ,与其互为等电子体的一种分子为 ▲ 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为 ▲ ,As原子采取 ▲ 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 ▲ 个Ga相连,As与Ga之间存在的化学键有 ▲ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
B.某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如下:

有关物质的部分物理性质如下:
|
| 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯甲醛 | —26 | 179 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸 | 122 | 249 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲醇 | -15.3 | 205.0 | 稍溶于水,易溶于乙醇、乙醚 |
| 乙醚 | -116.2 | 34.5 | 微溶于水,易溶于乙醇 |
实验步骤:
(1)在250 mL锥形瓶中,放入9 g KOH和9 mL水,配成溶液,冷却至室温。加入10.5 g新蒸馏的苯甲醛,塞紧瓶塞,用力振荡,使之变成糊状物,放置24 h。
①苯甲醛要求新蒸馏的,否则会使 ▲ (填物质名称)的产量相对减少。
②用力振荡的目的是 ▲ 。
(2)分离苯甲醇
①向锥形瓶中加入30 mL水,搅拌,使之完全溶解。冷却后倒入分液漏斗中,用30 mL乙醚萃取苯甲醇(注意留好水层)。30 mL 乙醚分三次萃取的效果比一次萃取的效果 ▲ (填“好”或“差”)。
②将醚层依次用饱和亚硫酸氢钠溶液、饱和碳酸钠溶液和水各5 mL洗涤,再用无水硫酸镁干燥。将干燥后的乙醚溶液转移到100 mL蒸馏烧瓶中,投入沸石,连接好普通蒸馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代号)。
A.水浴加热 B.油浴加热 C.沙浴加热 D.用酒精灯直接加热
③改用空气冷凝管蒸馏,收集 ▲ ℃的馏分。
(3)制备苯甲酸
在乙醚萃取过的水溶液中,边搅拌边加入浓盐酸酸化至pH=3.5左右。冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ▲ ;砷与溴的第一电离能较大的是 ▲ 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 ▲ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ▲ ,与其互为等电子体的一种分子为 ▲ 。

(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为 ▲ ,As原子采取 ▲ 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 ▲ 个Ga相连,As与Ga之间存在的化学键有 ▲ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
B.某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如下:

有关物质的部分物理性质如下:
|
|
熔点/℃ |
沸点/℃ |
溶解性 |
|
苯甲醛 |
—26 |
179 |
微溶于水,易溶于乙醇、乙醚 |
|
苯甲酸 |
122 |
249 |
微溶于水,易溶于乙醇、乙醚 |
|
苯甲醇 |
-15.3 |
205.0 |
稍溶于水,易溶于乙醇、乙醚 |
|
乙醚 |
-116.2 |
34.5 |
微溶于水,易溶于乙醇 |
实验步骤:
(1)在250 mL锥形瓶中,放入9 g KOH和9 mL水,配成溶液,冷却至室温。加入10.5 g新蒸馏的苯甲醛,塞紧瓶塞,用力振荡,使之变成糊状物,放置24 h。
①苯甲醛要求新蒸馏的,否则会使 ▲ (填物质名称)的产量相对减少。
②用力振荡的目的是 ▲ 。
(2)分离苯甲醇
①向锥形瓶中加入30 mL水,搅拌,使之完全溶解。冷却后倒入分液漏斗中,用30 mL乙醚萃取苯甲醇(注意留好水层)。30 mL 乙醚分三次萃取的效果比一次萃取的效果 ▲ (填“好”或“差”)。
②将醚层依次用饱和亚硫酸氢钠溶液、饱和碳酸钠溶液和水各5 mL洗涤,再用无水硫酸镁干燥。将干燥后的乙醚溶液转移到100 mL蒸馏烧瓶中,投入沸石,连接好普通蒸馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代号)。
A.水浴加热 B.油浴加热 C.沙浴加热 D.用酒精灯直接加热
③改用空气冷凝管蒸馏,收集 ▲ ℃的馏分。
(3)制备苯甲酸
在乙醚萃取过的水溶液中,边搅拌边加入浓盐酸酸化至pH=3.5左右。冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
某实验小组用0.5mol/LNaOH溶液和0.5mol/L硫酸溶液反应进行中和热的测定。
Ⅰ.配制0.5mol/LNaOH溶液。
(1)若实验中大约要使用245mlNaOH溶液,至少需要称量NaOH固体 g。
(2)从下列仪器中选择称量NaOH固体所需的仪器(填字母) 。
a.托盘天平(带砝码)b.小纸片c.小烧杯d.坩埚钳 e.玻璃棒 f.药匙 g.量筒
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示:
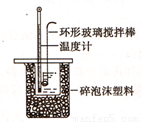
(1)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(2)取50mlNaOH溶液和30ml硫酸溶液进行实验,实验数据如表所示。
①请填写表中的空白:
|
温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/ ℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/ml,中和后生成溶液的比热容
C=4.18J/(g.℃)。则中和热△H= (取小数点后一位)。
③上述实验结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯
d.用量筒量取NaOH溶液的体积时仰视读数
某实验小组用0.5mol/LNaOH溶液和0.5mol/L硫酸溶液反应进行中和热的测定。
Ⅰ.配制0.5mol/LNaOH溶液。
(1)若实验中大约要使用245mlNaOH溶液,至少需要称量NaOH固体 g。
(2)从下列仪器中选择称量NaOH固体所需的仪器(填字母) 。
a.托盘天平(带砝码)b.小纸片c.小烧杯d.坩埚钳 e.玻璃棒 f.药匙 g.量筒
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示: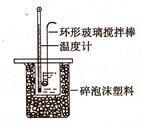
(1)写出该反应的用中和热表示的热化学方程式(中和热为57.3kJ/mol) 。
(2)取50mlNaOH溶液和30ml硫酸溶液进行实验,实验数据如表所示。
①请填写表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com