
题目列表(包括答案和解析)
| c2(OH-) |
| c(SO42-) |
| c2(OH-) |
| c(SO42-) |
| SO | 2- 4 |
| b-0.01 |
| b |
| b-0.01 |
| b |
某兴趣小组探究以芒硝Na2SO4·10H2O和CaO为原料制备Na2CO3。
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3。三元体系中反应的离子方程式为: SO42-+ Ca(OH)2(s)+2H2O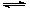 CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
该反应的平衡常数表达式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH=12.3 [即c(OH-)=0.02mol/L],可使反应在常温下容易进行。反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3。
(2)在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是_______________________________________________________________。
(3)添加的酸性物质须满足的条件(写出两点)是_____________、______________。
(4)用平衡移动原理解释添加酸性物质的理由:____________________________________;以HA表示所添加的物质,则总反应的离子方程式可写为_______________________。
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O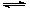 HCO3-+OH-。下列说法错误的是_________。
HCO3-+OH-。下列说法错误的是_________。
a.加水稀释,溶液中所有离子的浓度都减小
b.通入CO2,溶液pH减小
c.加入NaOH固体,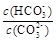 减小
减小
d.稀释溶液,平衡常数增大
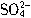 )=xmol?L-1,c(K+)=ymol?L-1时,x与y的关系是()。
)=xmol?L-1,c(K+)=ymol?L-1时,x与y的关系是()。  y
y y
y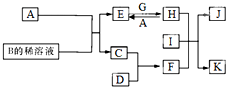 A~L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,可使湿润的红色石蕊试纸变蓝.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A~L为中学化学常见物质,其主要转化关系如图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,F为具有刺激性气味的气体,可使湿润的红色石蕊试纸变蓝.G和I分别由相同的两种元素组成,通常状况下均为无色液体.| 实验编号 | T/K | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 | 实验目的 |
| ① | 298 | 0.1 | 0.1 | 实验①和②探究温度对该反应速率的影响;实验①、③和④探究反应物浓度对该反应速率的影响 |
| ② | 308 | |||
| ③ | 0.2 | |||
| ④ | 0.1 |
| O | 2- 4 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体于试管中,加蒸馏水溶解 | |
| 步骤2: | |
| 步骤3: |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com