
题目列表(包括答案和解析)
 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题: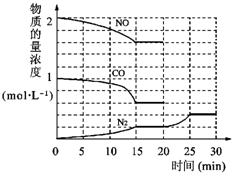 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素. O2+Hb?CO
O2+Hb?CO N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1| 0.4 |
| 15 |
| 0.4 |
| 15 |
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
(12分)已知2A2(g)+B2(g)  2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定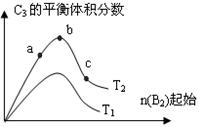
容积的容器中加入2 molA2和1 molB2,在5 00℃时充分反应,达平衡后C3的浓度为
00℃时充分反应,达平衡后C3的浓度为
w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平 衡后,吸收热量Q3
衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系 (用代数式表示)。
kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系 (用代数式表示)。
(2)能说明该反应已经达到平衡状态的是 。
a.v(C3)=2 v (B2); b.容器内压强保持不变
c.v逆(A2)=2 v正(B2) d.容器内的密度保持不变
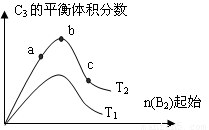
(3)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点时,平衡体系中A、B原子数之比接近2∶1
(4)若将上述容器改为恒压容 器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为: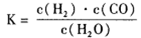
它所对应反应的化学方程式为_______。
已知在一定温度下,在同一平衡体系中各反应及平衡常数如下:
则K1、K2、K3之间的关系为_______。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应: , 该反应平衡常数随温度的变化如下:
, 该反应平衡常数随温度的变化如下:
该反应的逆反应方向是_______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为_______。
(3)甲醇是一种新型的汽车动力燃料,可通过CO和H2化合制备甲醇,该反应的热化学方程式为: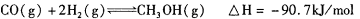
下列描述中能说明上述反应已达平衡的是_______;
A. 容器内气体的平均摩尔质量保持不变
B. 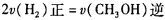
C. 容器中气体的压强保持不变
D. 单位时间内生成n molCO的同时生成2n mol H2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如下图所示,该燃料电池的电池反应式为 ,则负极的电极反应式为_______。
,则负极的电极反应式为_______。
(5) CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与
。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与 的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
(12分)已知2A2(g)+B2(g)
 2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为
w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3 之间满足何种关系 (用代数式表示)。
(2)能说明该反应已经达到平衡状态的是 。
 a.v(C3)=2 v (B2); b.容器内压强保持不变
a.v(C3)=2 v (B2); b.容器内压强保持不变
c.v逆(A2)=2 v正(B2) d.容器内的密度保持不变
(3)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
A.反应速率c>b>a
B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
D.b点时,平衡体系中A、B原子数之比接近2∶1
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com