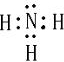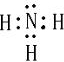(2010?合肥三模)以下是一些元素的信ο,其中有一种元素不在短周期.根据信ο完成问题:
| 元素A |
元素B |
元素C |
元素X |
元素Y |
元素Z |
| 单质是一种常见金属,与元素X形成黑色和砖红色两种化合物 |
单质是一种黄绿色气体 |
短周期中金属性最强,与X反应能生成两种化合物 |
最外层电子数是内层电子数的3倍,能形成双原子阴离子 |
单质为双原子分子,结构中σ键与π键数目比为1:2 |
阳离子就是一个质子 |
(1)写出A元素基态原子的核外电子排布式
1s22s22p63s23p63d104s1或[Ar]3d104s1
1s22s22p63s23p63d104s1或[Ar]3d104s1
.
(2)B、C、X的简单离子半径由大到小的顺序为
Cl->O2->Na+
Cl->O2->Na+
(用元素离子符号表示).
(3)化合物YZ
4B化学键的类型是
离子键和共价键
离子键和共价键
,检验该固体化合物中阳离子的实验的方法和现象是
取少量固体于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝
取少量固体于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝
.
(4)A元素的单质在潮湿空气中锈蚀生成绿色物质,用一个化学方程式表示锈蚀过程
2Cu+O2+CO2+H2O═Cu2(OH)2CO3
2Cu+O2+CO2+H2O═Cu2(OH)2CO3
.
(5)常温下,工业上用惰性电极在电解槽中电解100L 1.5mol?L
-1CB的水溶液时,两极共收集到气体22.4L(标准状况下),计算电解后阴极区溶液的pH=
12
12
(假设电解前后溶液体积不变).