
题目列表(包括答案和解析)
 下列说法正确的是( )
下列说法正确的是( ) ,可以简写为
,可以简写为 )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:


 )与Br2为主要起始物质,通过加成、消去两步反应制得.写出由苯乙烯制取苯乙炔的两步化学方程式(其他试剂自选).
)与Br2为主要起始物质,通过加成、消去两步反应制得.写出由苯乙烯制取苯乙炔的两步化学方程式(其他试剂自选).



| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2. | 1.5 | 2.5 | 2.8 | 4. | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
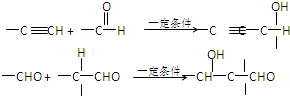





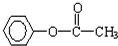 、
、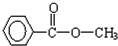 等
等 、
、 等
等

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com