
题目列表(包括答案和解析)
| a |
| 200b |
| a |
| 200b |
农业用化肥氯化铵的含量可通过下述方法来测定
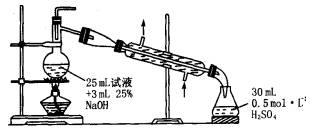
①称取1.000g试样溶于少量水中,然后移至250mL容量瓶中,并加水稀释至刻度。准确移取25.0mL试液注入蒸馏烧瓶中,加3.00mL25%NaOH溶液,然后小火加热蒸馏。
②用盛有30.0mL 0.0500mol•L-1硫酸的锥形瓶作为氨的接收器,加热40min~50min后,用蘸有浓盐酸的玻璃棒检验,当无NH3放出时停止加热。
③在锥形瓶中滴加甲基橙试液,然后用0.100mol•L-1NaOH溶液滴定直至终点时,共消耗了0.100mol•L-1NaOH溶液12.1mL。
(1)用甲基橙作指示剂,滴定终点时,溶液颜色由________色变为________色。
(2)实验步骤中,在滴定前________(填写字母:A.需要;B.不需要;C.洗涤不洗涤都可以)用少量水多次洗涤冷凝管内壁,洗涤液收集于锥形瓶中原因是________(填写字母:A.否则会使测定值偏高;B.否则会使测定值偏低;C.对测定无影响)。
(3)计算样品中NH4Cl的质量分数和铵态氮的质量分数的结果为w(NH4Cl)=________, w(N)=________。
(4)该实验装置是否可用于石油分馏?为什么?

①称取1.000g试样溶于少量水中,然后移至250mL容量瓶中,并加水稀释至刻度。准确移取25.0mL试液注入蒸馏烧瓶中,加3.00mL25%NaOH溶液,然后小火加热蒸馏。
②用盛有30.0mL 0.0500mol•L-1硫酸的锥形瓶作为氨的接收器,加热40min~50min后,用蘸有浓盐酸的玻璃棒检验,当无NH3放出时停止加热。
③在锥形瓶中滴加甲基橙试液,然后用0.100mol•L-1NaOH溶液滴定直至终点时,共消耗了0.100mol•L-1NaOH溶液12.1mL。
(1)用甲基橙作指示剂,滴定终点时,溶液颜色由________色变为________色。
(2)实验步骤中,在滴定前________(填写字母:A.需要;B.不需要;C.洗涤不洗涤都可以)用少量水多次洗涤冷凝管内壁,洗涤液收集于锥形瓶中原因是________(填写字母:A.否则会使测定值偏高;B.否则会使测定值偏低;C.对测定无影响)。
(3)计算样品中NH4Cl的质量分数和铵态氮的质量分数的结果为w(NH4Cl)=________, w(N)=________。
(4)该实验装置是否可用于石油分馏?为什么?
| 滴定 次数 |
待测溶液的体积 /mL |
标准溶液的体积/mL | 滴定前刻度 | 滴定后刻度 | 1 | 10.00 | 1.02 | 21.03 | 2 | 10.00 | 2.00 | 21.99 | 3 | 10.00 | 0.20 | 20.20 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com