
题目列表(包括答案和解析)
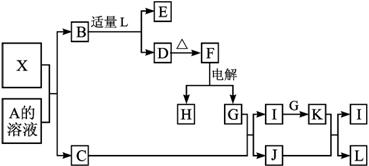
图1-3-21
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色沉淀,E溶液的焰色反应中火焰呈黄色。完成以下各题:
(1)写出X的化学式:__________,X属于__________晶体(填“原子”“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:______________________________。写出K与J反应的化学方程式:____________________。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料,是最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式):![]() +2N2
+2N2![]() 4X+SiC+3C。
4X+SiC+3C。

|
在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在.后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子.21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族.下列有关说法错误的是 | |
A. |
熔点比较:C60<C70<C90<金刚石 |
B. |
已知C(石墨,s) |
C. |
C60晶体如图,每个C60分子周围与它距离最近且等距离的C60分子有10个
|
D. |
金刚石与C60、C70、管状碳和洋葱状碳都不能与H2发生加成反应 |

| ||
| ||
| 实验编号 | 1 | 2 | 3 |
| 混合物的质量/g | 3.76 | 4.70 | 8.46 |
| 硫酸溶液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量/mol | 0.03 | 0.0375 | 0.03 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com