某化学兴趣小组测定某FeCl
3样品(含有少量FeCl
2杂质)中铁元素的质量分数,实验时按以下步骤进行:
①称量ag样品,置于烧杯中,
②加入适量的蒸馏水,使样品溶解,然后准确配制成250mL溶液
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全
⑤过滤,洗涤沉淀
⑥将沉淀声称到坩埚内加热,搅拌直到固体全部由红褐色变为红棕色后在干燥器中冷却到室温后,称量
⑦…根据上面叙述,回答
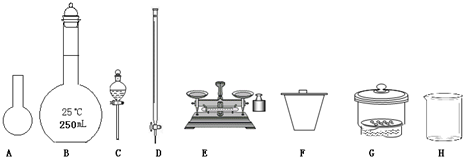
(1)如图所示仪器中,本实验步骤①②中必须用到的仪器是
BE
BE
.
(2)写出步骤③和④中发生反应的离子方程式
2Fe2++Cl2=2Fe3++2Cl-;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
2Fe2++Cl2=2Fe3++2Cl-;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
(3)洗涤是洗去附着在沉淀上的
NH4+、Cl-、OH-
NH4+、Cl-、OH-
(写离子符号).洗涤沉淀的操作是
向过滤器中加入蒸馏水至没过沉淀,待滤液流出后重复上述操作多次直至洗净为止
向过滤器中加入蒸馏水至没过沉淀,待滤液流出后重复上述操作多次直至洗净为止
检验沉淀已洗净的方法是
取最次一次洗出液置于小试管中,滴加AgNO3溶液若无沉淀产生证明已洗净
取最次一次洗出液置于小试管中,滴加AgNO3溶液若无沉淀产生证明已洗净
(4)若坩埚质量是W
1,坩埚与加热后固体总质量是W
2,则样品中铁元素的质量分数为
(列出算式,不需化简)
(5)该兴趣小组中甲学生认为:实验步骤中不加氨水,其余步骤不变,仍可达到实验目的,你认为甲学的观点是否正确
正确
正确
(填“正确”或“错误”)请说明理由(必要时可用化学方程式表示)
氯化铁溶液中Fe3+水解Fe3++3H2O?Fe(OH)3+3H+,加热HCl挥发,促进水解进行,过一系列转化最终都能生成Fe2O3对后续实验无影响
氯化铁溶液中Fe3+水解Fe3++3H2O?Fe(OH)3+3H+,加热HCl挥发,促进水解进行,过一系列转化最终都能生成Fe2O3对后续实验无影响
.

