(2011?宝鸡三模)由短周期元素组成的单质X
2、Y,标准状况下气体X
2的密度为3.17g?L
-1;常温下,Y为浅黄色固体.Z是一种化合物,焰色反应呈黄色,且常温下,0.1mol?L
-1Z的水溶液pH=13.
请回答下列问题:
(1)写出常温下单质X
2与Z的水溶液反应的离子方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.
(2)已知16g固体单质Y,完全燃烧生成气态产物时放出148kJ热量,试写出Y固体在氧气中完全燃烧时的热化学方程式
S(s)+O
2(g)
SO
2(g)△H=-296kJ/mol
S(s)+O
2(g)
SO
2(g)△H=-296kJ/mol
.
(3)已知Y与Z的水溶液发生反应可生成两种盐A和B,其中A与70%的硫酸反应生成能使品红溶液褪色的气体.
则:①A的化学式是
Na2SO3
Na2SO3
;A的水溶液pH>7;原因是一
SO32-+H2O?HSO3-+OH-;HSO3-+H2O?H2SO3+OH-
SO32-+H2O?HSO3-+OH-;HSO3-+H2O?H2SO3+OH-
(用离子方程式表示),A的水溶液中离子浓度由大到小顺序为
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
.
②将20mL 0.25mol?L
-1B溶液逐滴加入20mL0.4mol?L
-1KMnO
4溶液(经硫酸酸化)时,溶液恰好褪为无色.写出该反应的离子方程式
5S2-+8MnO4-+24H+=5SO42-+8Mn2++12H2O
5S2-+8MnO4-+24H+=5SO42-+8Mn2++12H2O
.
(4)工业上常以石墨和铁分别做电极,用隔膜法电解某盐溶液来生产X
2和Z.写出电解该盐溶液的化学方程式
.


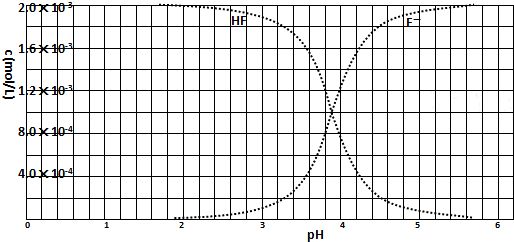
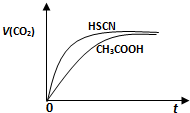

 (2010?浙江)已知:
(2010?浙江)已知: