
题目列表(包括答案和解析)
|
可逆反应:N2+3H2 | |
| [ ] | |
A. |
3 |
B. |
|
C. |
2 |
D. |
|
(1)氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
(1)已知:H-H键能为436 KJ·mol-1,N≡N键能为945KJ·mol-1,N-H键能为391 KJ·mol-1.写出合成氨反应的热化学方程式:________
(2)可逆反应N2+3H2![]() 2NH3在恒容密闭容器中进行,达到平衡状态的标志是________.
2NH3在恒容密闭容器中进行,达到平衡状态的标志是________.
①单位时问内生成n mo1 N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
③容器中N2、H2、NH3的物质的量为1∶3∶2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2 L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
5 min内,消耗N2的平均反应速率为________;此条件下该反应的化学平衡常数K=________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2 mol,化学平衡将向________(填“正反应”或“逆反应”)方向移动.
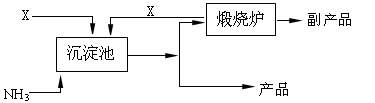
(4)氨是氮肥工业的重要原料.某化肥厂以天然石膏矿(主要成分CaSO4)为原料生产铵态氮肥(NH4)2SO4,(已知Ksp(CaSO4)=7.10×10-5 Ksp(CaCO3)=4.96×10-9)其工艺流程如下:
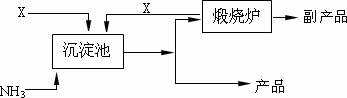
请写出制备(NH4)2SO4的反应方程式:________;并利用有关数据简述上述反应能发生的原因________.
 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是 | 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2 2NH3 △H=" -" 92.4kJ/mol
2NH3 △H=" -" 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
此温度下该反应的平衡常数K= 。
②欲提高H2的转化率,下列措施可行的是 。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)  2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
①用O2表示从0~2s内该反应的平均速率v=___________。
②能说明该反应已经达到平衡状态的是_________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
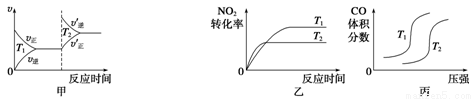
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2 2NH3 △H= - 92.4kJ/mol
2NH3 △H= - 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
此温度下该反应的平衡常数K= 。
②欲提高H2的转化率,下列措施可行的是 。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g) 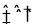 2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
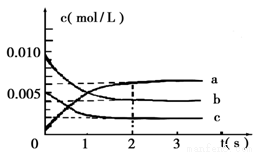
①用O2表示从0~2s内该反应的平均速率v=___________。
②能说明该反应已经达到平衡状态的是_________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。4CO(g)+2NO2(g)  4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com