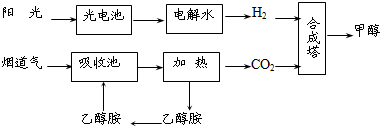
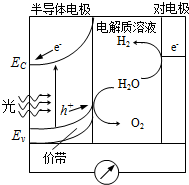
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N
2在催化剂(掺有少量Fe
2O
3的TiO
2)表面与水发生反应,生成的主要产物为NH
3.进一步研究NH
3生成量与温度的关系,部分实验数据见下表(光照、N
2压力1.0×10
5 Pa、反应时间3h):
| T/K |
303 |
313 |
323 |
353 |
| NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的化学方程式:N
2(g)+3H
2O(l)?2NH
3(g)+
O
2(g)△H=+765.2kJ?mol
-1回答下列问题:
(1)该反应在较低温度下能否自发进行?
;
(2)从323K到353K,氨气的生成量减少的原因
;
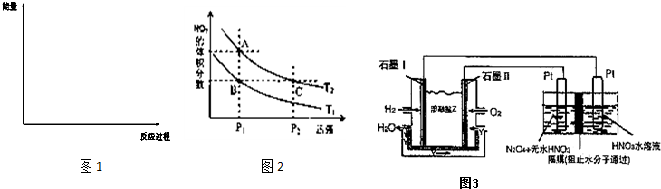
(3)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图1,并进行必要标注;
(4)工业合成氨的反应为N
2(g)+3H
2(g)?2NH
3(g).设在容积为2.0L的密闭容器中充入0.60mol N
2(g)和1.60mol H
2(g),反应在一定条件下达到平衡时,NH
3的物质的量分数(NH
3的物质的量与反应体系中总的物质的量之比)为
.该条件下反应2NH
3(g)?N
2(g)+3H
2(g)的平衡常数为
;
(5)利用N
2和H
2可以实验NH
3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
已知:N
2(g)+O
2(g)═2NO(g)△H=+180.5kJ?mol
-1N
2(g)+3H
2(g)═2NH
3(g)△H=-92.4kJ?mol
-12H
2(g)+O
2(g)═2H
2O(g)△H=-483.6kJ?mol
-1则氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式为
;
(6)对反应N
2O
4(g)?2NO
2(g),在温度分别为T
1、T
2时,平衡体系中NO
2的体积分数随压强变化曲线如图2所示.下列说法正确的是
;
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(7)现以H
2、O
2、熔融盐Na
2CO
3组成的燃料电池,采用电解法制备N
2O
5,装置如图3所示,其中Y为CO
2.写出石墨I电极上发生反应的电极反应式
;在电解池中生成1molN
2O
5转移电子的物质的量为
.


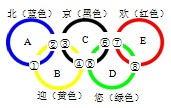 (2011?江山市模拟)第28届夏季奥运会在北京成功举办,向世界人民展示了中国人的风采和北京的魅力.奥运五环象征着五大洲的团结以及全世界运动员以公正、坦率的比赛和友好的精神.“北京欢迎您”不仅是北京奥运会的主题歌也是吉祥物的“名字”也正好是五个环相一致(如图所示).
(2011?江山市模拟)第28届夏季奥运会在北京成功举办,向世界人民展示了中国人的风采和北京的魅力.奥运五环象征着五大洲的团结以及全世界运动员以公正、坦率的比赛和友好的精神.“北京欢迎您”不仅是北京奥运会的主题歌也是吉祥物的“名字”也正好是五个环相一致(如图所示).

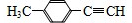



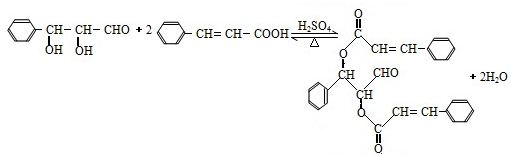

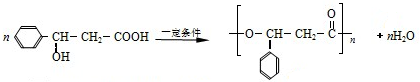 或
或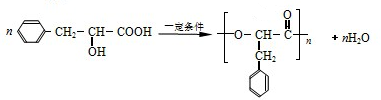
 或
或